
【题目】下图是有关FeSO4的转化关系 (无关物质已略去)。

已知:①X由两种化合物组成,将X通入品红溶液,溶液退色;通入BaCl2溶液,产生白色沉淀。②Y是红棕色的化合物。
(1) 气体X的成分是(填化学式)________。
(2) 反应Ⅰ的反应类型属于(填序号)________。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3) 溶液2中金属阳离子的检验方法是____________________________________________。
(4) 若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅰ的化学方程式是_______________________________________________,
反应Ⅳ中生成FeSO4的离子方程式是_____________________________________________。
(5) 一瓶长期露置在空气中的FeSO4溶液,为检验其是否完全变质,则需要的试剂是___________(填写名称)。
【答案】SO2、SO3a、e取少量溶液2中的溶液加入几滴KSCN试液,溶液变红色2FeSO4![]() Fe2O3+SO2↑+SO32Fe3+ + SO32-+ H2O =2Fe2++SO42-+ 2H+酸性高锰酸钾溶液
Fe2O3+SO2↑+SO32Fe3+ + SO32-+ H2O =2Fe2++SO42-+ 2H+酸性高锰酸钾溶液
【解析】
本题考查的是框图式物质推断题,抑制反应物,利用物质的特点,顺向褪即可,关键须掌握铁和硫相关化合物的性质。
(1)硫酸亚铁受热分解,生成气体X,X通入品红溶液,溶液褪色是二氧化硫,通入氯化钡溶液,产生白色沉淀是三氧化硫,所以X为 SO2、SO3 。(2)从硫酸亚铁受热分解的方程式可看出由硫酸亚铁一种化合物分解,生成三种化合物,是分解反应,硫元素从+6价,变成产物中的二氧化硫中的+4价,铁从+2价,变成产物中的+3价,故答案为:a、e。(3)溶液2中金属阳离子是由氧化铁溶于稀硫酸得到,检验溶液2中金属阳离子,实际就是检验溶液中的铁离子,铁离子与硫氰化钾溶液租用变为血红色,利用这一性质检验,所以操作方法为:取少量溶液2中的溶液加入几滴KSCN试液,溶液变红色。(4)硫酸亚铁分解生成氧化铁和二氧化硫和三氧化硫,方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3 。硫酸铁和亚硫酸钠反应生成硫酸亚铁和硫酸,离子方程式为:2Fe3+ + SO32-+ H2O =2Fe2++SO42-+ 2H+ 。 (5)长期露置在空气中的FeSO4溶液,会变质为铁整理,为了检验其是否完全变质,即检验是否含有亚铁离子,根据亚铁离子能与酸性高锰酸钾溶液反应而使酸性高锰酸钾溶液褪色,所以使用酸性高锰酸钾溶液。
Fe2O3+SO2↑+SO3 。硫酸铁和亚硫酸钠反应生成硫酸亚铁和硫酸,离子方程式为:2Fe3+ + SO32-+ H2O =2Fe2++SO42-+ 2H+ 。 (5)长期露置在空气中的FeSO4溶液,会变质为铁整理,为了检验其是否完全变质,即检验是否含有亚铁离子,根据亚铁离子能与酸性高锰酸钾溶液反应而使酸性高锰酸钾溶液褪色,所以使用酸性高锰酸钾溶液。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:

(1)元素Ga在元素周期表中的位置为:______________。
(2)Sn的最高正价为________,Cl的最高价氧化物对应水化物的化学式为________,Bi的最高价氧化物的化学式为________。
(3)根据元素周期律,推断:
①阴影部分元素形成的氢化物中沸点最高的是________。
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4________H2SeO4(填“>”、“<”、“=”或“无法比较”)。
③氢化物的还原性:H2O________H2S(填“>”、“<”、“=”或“无法比较”)。
④原子半径比较:N________Si(填“>”、“<”、“=”或“无法比较”)。
(4)可在图中分界线(虚线部分)附近寻找________(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)若比较C、Si的非金属性强弱,请从下列试剂中选择最佳试剂组合进行实验, 请写出实验过程:(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液) _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是( )
A.任何物质里都含有化学键
B.离子化合物中可能含有共价键
C.共价化合物分子中可能含有离子键
D.水分子中氢、氧原子间的化学键是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
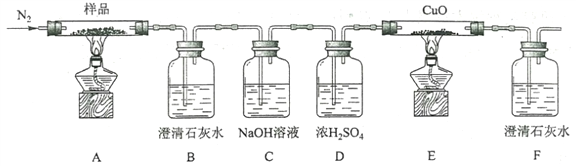
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的气态物质。
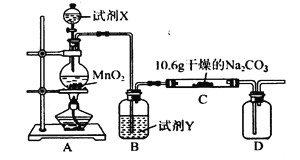
(1)装置A中发生反应的离子方程式为_______________________________________。
(2)装置B中试剂Y应为_________________。
(3)已知在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物),装置C中只有氯化钠和碳酸氢钠。若C中有0.1 mol Cl2参加反应,可推知C中反应生成的含氯氧化物为______________(写化学式)。
(4)该实验装置中明显存在不足之处,改进的措施为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知干冰晶胞结构属于面心立方最密堆积,晶胞中最近的相邻两个CO2 分子间距为apm,阿伏加德罗常数为NA,下列说法正确的是
A. 晶胞中一个CO2分子的配位数是8
B. 晶胞的密度表达式是![]() g/cm3
g/cm3
C. 一个晶胞中平均含6个CO2分子
D. CO2分子的空间构型是直线形,中心C原子的杂化类型是sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,下列关于各实验装置的叙述正确的是( )

A. 装置③可用于收集H2、CO2、Cl2、NH3等气体
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置①常用于分离互不相溶的液体混合物
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酰氰酯(结构简式为 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(1)基态钴原子的核外电子排布式为________________。组成HClO4-NaClO4的4种元素的电负性由小到大的顺序为____________________。
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是____________、___________, 1个氯磺酰氰酯分子中含有σ键的数目为______________,氯磺酰氰酯中5种元素的第一电离能由大到小的顺序为_________________。
(3)ClO4-的空间构型为__________________。
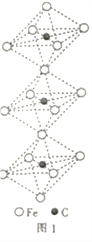
(4)一种由铁、碳形成的间隙化合物的晶体结构如图1所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为________________。
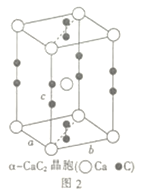
(5)电石(CaC2)是制备氯化氰(ClCN)的重要原料。四方相碳化钙(CaC2)的晶胞结构如上图2所示,其晶胞参数分别为a、b、c,且a=b,c=640pm。已知四方相碳化钙的密度为1.85g·cm-3,[C≡C]2-中键长为120pm,则成键的碳原子与钙原子的距离为________pm和_______pm。(设阿伏加德罗常数的数值为6×1023)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是
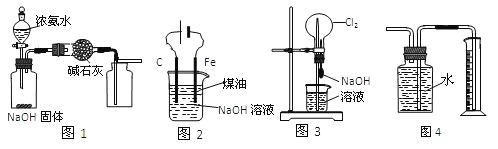
A. 用图1装置制取干燥纯净的NH3
B. 用图2装置制备Fe(OH)2并能较长时间观察其颜色
C. 用图3装置可以完成“喷泉”实验
D. 用图4装置测量Cu与浓硝酸反应产生气体的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com