
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.在稀硫酸中加入少量氢氧化钠固体,溶液导电性增强
B.饱和碳酸钠溶液中:c(Na+)=2c(CO32-)
C.饱和食盐水中:c(Na+) + c(OH-)c(Cl-)+ c(H+)
D.pH=12的NaOH溶液中:c(OH-)=1.0×10-2 mol·L-1
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:2016届广东省顺德市高三上第四次月考理综化学试卷(解析版) 题型:选择题
部分弱电解质的电离平衡常数如下表:
弱电解质 | HCOOH | HCN | H2CO3 | NH3·H2O |
电离平衡常数 (25 ℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
下列说法不正确的是
A.结合H+的能力:CO32->CN->HCO3->HCOO-
B.0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-)
C.25 ℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水)
D.HCN + HCOONa = NaCN + HCOOH
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期月考化学试卷(解析版) 题型:选择题
下列说法正确的是
① 标准状况下,6.02×1023个分子所占的体积约是22.4L
②0.5molH2所占体积为11.2L
③标准状况下,1molH2O的体积为22.4L
④标准状况下,28gCO与N2的混合气体的体积约为22.4L
⑤各种气体的气体摩尔体积都约为22.4L/mol
⑥标准状况下,体积相同的气体的分子数相同
A.①③⑤ B.④⑥ C.③④⑥ D.①④⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上第三次月考化学试卷(解析版) 题型:选择题
某温度下,对于反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
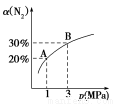
A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中考试化学试卷(解析版) 题型:选择题
用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL 0.3mol·L-1的NaCl溶液和300mL 0.2mol·L-1的AgNO3溶液,当产生0.56L(标况)Cl2时,停止电解,取出电极,将两杯溶液混合,混合液的pH为(混合后溶液体积为500mL)
A.1.4 B.5.6 C.7 D.12.6
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次月考化学试卷(解析版) 题型:选择题
A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是
A.C元素的最高正价为+7价
B.原子半径:A>B>C
C.离子半径:A2->C->B2+
D.还原性:A2-<C-
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1mol正盐的△H=-24.2kJ•mol-1,强酸、强碱稀溶液反应的中和热为△H=-57.3kJ•mol-1,则NH3·H2O在水溶液中电离的△H等于
A.-69.4 kJ/mol B.-45.2kJ/mol C.+69.4 kJ/mol D.+45.2 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016届山东省北校高三上学期第二次单元测试化学试卷(解析版) 题型:实验题
(一)如图所示,甲、乙是电化学实验装置,请回答下列问题:
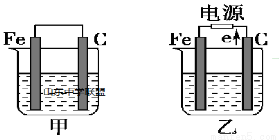
若甲、乙两个烧杯中均盛放饱和NaCl溶液。
①甲中石墨棒上的电极反应式是_________________________________
②乙中总反应的离子方程式为___________________________________
③若乙中含有0.10 mol·L-1NaCl溶液400mL,当阳极产生的气体为560mL(标准状况下)时,溶液的pH=_____________(2分)(假设溶液体积变化忽略不计),转移电子的个数为____________
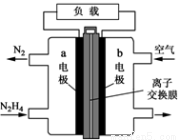
(二)肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景。其工作原理如上图所示,回答下列问题:
①该燃料电池中正极通入的物质是__________;
负极发生的反应式为:__________________________
②电池工作时,OH- 移向极________(“a”或“b”)
③当电池放电转移5mol电子时,至少消耗燃料肼________g
(三)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42﹣.电池放电时,负极的电极反应为:V2+﹣e﹣=V3+.
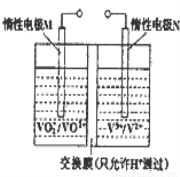
①电池放电时的总反应方程式为___________________________
充电时,电极M应接电源的_________ 极
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前 需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+.则第一步反应过程中阴极区溶液n(H+)_________ _(填“增大”、“不变”或“减小”) (1分),阳极的电极反应式为_________________________
_(填“增大”、“不变”或“减小”) (1分),阳极的电极反应式为_________________________
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:选择题
下列有关化学平衡常数K的说法中,正确的是( )
A.K的大小与起始浓度有关
B.温度越高,K值越大
C.K值越大,反应物的转化率越大
D.K值越大,正向反应进行的程度越小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com