
下列各组中的反应,属于同一反应类型的是
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由氯代环己烷消去制环己烯;由丙烯加溴制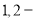 二溴丙烷
二溴丙烷
D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年天津市武清区等五区县高二上期中化学卷(解析版) 题型:选择题
反应 3NO2(g)+H2O(l) 2HNO3(aq)+NO(g) △H<0。达到平衡后,改变下列条件,可使HNO3浓度增大的是
2HNO3(aq)+NO(g) △H<0。达到平衡后,改变下列条件,可使HNO3浓度增大的是
A.升温 B.减压 C.加水 D.通入O2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市河东区高二上学期期中质检化学试卷(解析版) 题型:选择题
已知在25℃时,下列反应的平衡常数如下:
①N2(g)+O2(g) 2NO(g) K1=1×10-30
2NO(g) K1=1×10-30
②2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
③2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列说法正确的是
A.NO分解反应NO(g)
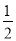 N2(g)+
N2(g)+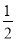 O2(g)的平衡常数为1×10-30
O2(g)的平衡常数为1×10-30
B.根据K2的值可以判断常温下H2和O2很容易反应生成H2O
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2
D.温度升高,上述三个反应的平衡常数均增大
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上11月模拟化学卷(解析版) 题型:选择题
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质。下列说法错误的是
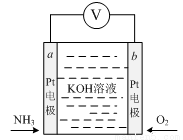
A.溶液中OH﹣向电极a移动
B.负极的电极反应式为:2NH3﹣6e﹣+6OH﹣=N2↑+6H2O
C.O2在电极b上发生还原反应
D.反应消耗的NH3与O2的物质的量之比为4:5
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上月考三化学试卷(解析版) 题型:实验题
某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体和胆矾晶体。
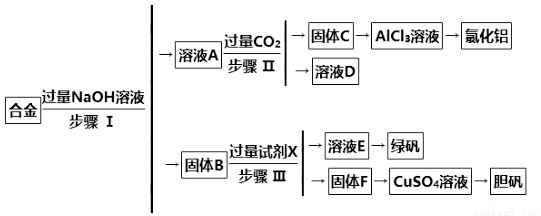
请回答:
(1)写出绿矾的化学式:______ ____________。试剂X是 。
____________。试剂X是 。
(2)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是____________。
(3)溶液E得到绿矾晶体的实验操作 。
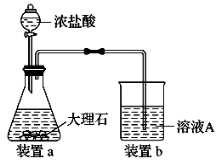
(4)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察 到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是__________。
到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是__________。
(5)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式:__________________________,
请选出你认为的最佳途径并说明选择的理由:______________________________。
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古高三上学期期中化学试卷(解析版) 题型:实验题
硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:

(1) 完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +__________+H2O;双氧水的作用是 。
(2)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为 ,滤液B中除Cu2+外, 还含有的金属阳离子是 。
(3)将滤液B通过 、 ,过滤,洗涤等操作可得到硫酸铜晶体。
(4)硫酸铜也可以用硫化铜和氧气在高温 条件下化合制得,该反应的化学方程式 。
条件下化合制得,该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古高三上学期期中化学试卷(解析版) 题型:选择题
下列关于碳酸钠和碳酸氢钠的性质叙述正确的是( )
A、受热时NaHCO3比Na2CO3稳定
B、等质量NaHCO3、Na2CO3分别与足量盐酸反应,NaHCO3放出CO2更多
C、在水中NaHCO3比Na2CO3溶解度大
D、物质的量相等的NaHCO3和Na2CO3分别与足量盐酸反应,放出CO2的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学卷(解析版) 题型:选择题
室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是
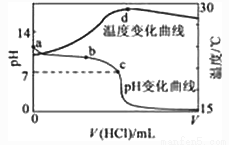
A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点:c(NH4+)+c( NH3·H2O) >c(Cl-)
NH3·H2O) >c(Cl-)
C.b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:选择题
25℃时,下列四种溶液,由水电离产生的c(H+)之比①∶②∶③∶④是( )
①pH=0的盐酸 ②0.1 mol/L的盐酸
③0.01 mol/LNaOH溶液 ④pH=11的NaOH溶液
A.1∶10∶100∶1000 B.0∶1∶12∶11
C.14∶13∶12∶11 D.14∶13∶2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com