
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将Cu片放入浓H2SO4中 | 生成刺激性气味气体 | Cu与浓H2SO4反应生成SO2 |
| B | Al2(SO4)3溶液中滴加过量氨水 | 生成白色胶状物质 | Al(OH)3不溶于氨水 |
| C | 向某溶液中加入新制氯水,再向溶液中加入KSCN溶液 | 溶液变红色 | 该溶液中含有Fe2+ |
| D | 向某溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 该溶液中存在I- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.常温下将Cu片放入浓H2SO4中,不发生反应;
B.Al2(SO4)3溶液中滴加过量氨水,反应生成氢氧化铝沉淀;
C.原溶液中可能存在Fe3+;
D.下层呈紫红色,原溶液存在碘单质.
解答 解:A.常温下将Cu片放入浓H2SO4中,不发生反应,加热反应生成二氧化硫,现象与结论不合理,故A错误;
B.Al2(SO4)3溶液中滴加过量氨水,反应生成氢氧化铝白色沉淀,可知Al(OH)3不溶于氨水,故B正确;
C.原溶液中可能存在Fe3+,检验亚铁离子,应先加入KSCN溶液无现象,再加氯水溶液为血红色,故C错误
D.下层呈紫红色,原溶液存在碘单质,不能判断是否含碘离子,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、发生的反应、离子检验及萃取现象等,把握物质性质、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:解答题
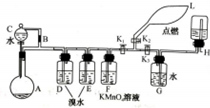 有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目:
有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7 g羟基所含有的电子数为NA | |
| B. | 标准状况下,11.2L苯含有的氢原子数为3NA | |
| C. | 28 g乙烯和环丙烷(C3H6)的混合气体中含有的碳原子数为2NA | |
| D. | 1mol乙醇和1mol乙酸和浓硫酸共热,充分反应后生成乙酸乙酯分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
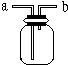 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S | B. | KNO3 | C. | C | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 |
| V(O2)/L | 0.0 | 9.9 | 17.2 | V=? |
| A. | 0~2min H2O2平均反应速率比4~6min慢 | |
| B. | 反应至6min时,共产生O244.8L | |
| C. | 0~6min的平均反应速率 v(H2O2)≈3.3×10-2mol•L-1•min-1 | |
| D. | 反应至6min时,c(H2O2)=0.3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生还原反应的是C2O42- | |
| B. | 该离子方程式右侧方框内的产物是OH- | |
| C. | 10mol H+参加反应时,电子转移5mol | |
| D. | 1mol草酸分子中含有9mol共用电子对 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com