
| A. | $\frac{1}{2}$N2H4+$\frac{1}{2}$O2═$\frac{1}{2}$N2+H2O△H=-267 kJ•mol-1 | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-133.5 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534 kJ | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534 kJ•mol-1 |
分析 根据热化学方程式的意义以及热化学方程式的书写方法可知,书写热化学方程式时应标注物质的聚集状态,放热反应的反应热为负值,化学计量数要和反应热成比例,据此进行解答.
解答 解:A物质状态影响其具有能量,则.热化学方程式中必须注明物质所处状态,故A错误;
B.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,故B错误;
C.该反应为放热反应,其焓变应该为负值,且生成水的状态应该为液态,故C错误;
D.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ•mol-1,故D正确;
故选D.
点评 本题考查学生热化学方程式的意义以及热化学方程式的书写方法,题目难度不大,明确热化学方程式的书写原则为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
在Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O,下列有关该反应说法正确的是
A.硝酸表现出了氧化性和酸性 B.还原剂与氧化剂之比为1:4
C.每个硝酸分子得到2个电子 D.硝酸铜是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物 | B. | 单质 | C. | 氧化物 | D. | 化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
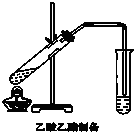 (1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
(1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.| 物质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | ||
| 酒精(水) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com