
【题目】实验室分别用以下4个装置完成实验。下列有关装置、试剂和解释都正确的是
A.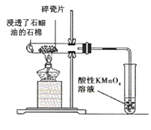 中碎瓷片为反应的催化剂,酸性KMnO4溶液褪色可证明有乙烯生成
中碎瓷片为反应的催化剂,酸性KMnO4溶液褪色可证明有乙烯生成
B. 所示装置(秒表未画出)可以测量锌与硫酸溶液反应的速率
所示装置(秒表未画出)可以测量锌与硫酸溶液反应的速率
C.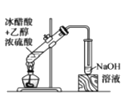 为实验室制备乙酸乙酯的实验,浓硫酸起到催化剂和脱水剂的作用
为实验室制备乙酸乙酯的实验,浓硫酸起到催化剂和脱水剂的作用
D. 为铜锌原电池装置,盐桥中的阳离子向右池迁移起到形成闭合电路的作用
为铜锌原电池装置,盐桥中的阳离子向右池迁移起到形成闭合电路的作用
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】铁和钴是重要的过渡元素。
(1)钴位于元素周期表中第___族,基态钴原子中未成对电子的个数为_____。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中中心离子Fe3+的核外价电子排布式为___;尿素分子中氮原子的杂化方式是___,尿素中所含非金属元素的电负性由大到小的顺序是___。
(3)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:
在第一种配合物溶液中加硝酸银溶液产生白色沉淀。
在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,则第二种配合物的配体为_____。
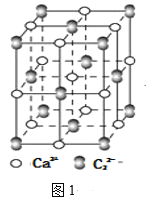
(4)离子化合物CaC2的一种晶体结构如图1所示,从钙离子看,属于____堆积,其配位数是_____;一个晶胞中平均含有的π键的个数为_____。
(5)科学研究结果表明。碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH,其反应原理如下:2CO2+2H2O=2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是____。
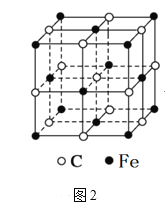
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图2所示,则该物质的化学式为______,若晶体密度为ρg/cm3,则晶胞中最近的两个碳原子的距离为_____pm(阿伏加德罗常数的值用NA表示,写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中铁棒上析出铜,而铁的质量不变,符合要求的原电池是
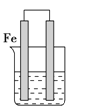
A.铁棒做负极,铜棒做正极,电解质溶液是CuSO4溶液
B.锌棒做负极,铁棒做正极,电解质溶液是CuSO4溶液
C.锌棒做负极,铁棒做正极,电解质溶液是FeCl3溶液
D.铁棒做负极,铜棒做正极,电解质溶液是H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在 Cu-ZnO-ZrO2 催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+*H,带*标记的物质是该反应历程中的中间产物或过渡态)。下列说法错误的是
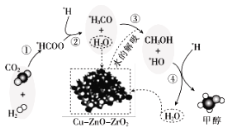
A.第①步中CO2和H2分子中都有化学键断裂
B.水在整个历程中可以循环使用,整个过程不消耗水也不产生水
C.第③步的反应式为:*H3CO+H2O→CH3OH+*HO
D.第④步反应是一个放热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.Fe溶于足量稀HNO3:3Fe+8H++2![]() =3Fe2++2NO↑+4H2O
=3Fe2++2NO↑+4H2O
B.NaHCO3溶液与NaOH溶液反应:![]() +OH-=CO2↑+H2O
+OH-=CO2↑+H2O
C.向NaAlO2溶液中加入过量的稀HCl:![]() +H++H2O=Al(OH)3↓
+H++H2O=Al(OH)3↓
D.氨水和醋酸溶液混合:NH3H2O+CH3COOH=NH4++CH3COO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是未来最理想的能源,最近科学家研制出利用太阳能产生激光,在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。请回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。请回答下列问题:
(1)太阳光分解海水时,实现了_____能转变为_______能,二氧化钛作_______。生成的氢气用于燃料电池时,实现了_______能转变为_______能。太阳光分解海水的反应属于_______(填“放热”或“吸热”)反应。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-=2H2O;B极:O2+4e-=2O2-,则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)请根据下列信息,写出H2燃烧热的热化学方程式________。
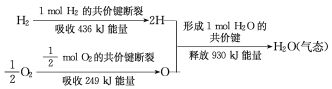
H2O(l) = H2O(g) ΔH = +44kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予美国科学家约翰古迪纳夫、斯坦利惠廷厄姆和日本科学家吉野彰,以表彰他们在锂离子电池研发领域作出的贡献。近日,有化学家描绘出了一种使用DMSO(二甲基亚砜)作为电解液,并用多孔的黄金作为电极的锂—空气电池的实验模型,该电池放电时在多孔的黄金上氧分子与锂离子反应,形成过氧化锂(Li2O2),其装置图如图所示。下列有关叙述正确的是
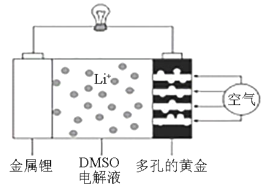
A.DMSO电解液能传递Li+和电子,不能换成水溶液
B.该电池放电时每消耗2molO2,转移4mol电子
C.该池放电时,外电路中电流的方向为从金属锂电极流出
D.多孔的黄金为电池正极,电极反应式可能为O2+4e-=2O2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com