


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.温度相等、体积相同的O2和N2 | B.压强相同、体积相同的 O2和N2 |
| C.体积相等、密度相等的CO和C2H4 | D.质量相等、密度不等的N2和CO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所用NaOH已经潮解 | B.有少量NaOH溶液残留在烧杯里 |
| C.向容量瓶中加水定容时俯视 | D.称量时误用“左码右物” |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.含n molHCl的浓盐酸与足量MnO2反应可生成n NA /4 个氯分子() |
B.在密闭容器中建立了N2+3H2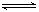 2NH3的平衡,每有17gNH3生成,必有0.5NA个NH3分子分解 2NH3的平衡,每有17gNH3生成,必有0.5NA个NH3分子分解 |
| C.同温同压同体积的CO2和SO2所含氧原子数均为2NA |
| D.20 g重水(D2O)中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol Cl2作为氧化剂得到的电子数为NA |
| B.在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子 |
| C.14 g氮气中含有7 NA个电子 |
| D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.80 mL | B.100 mL | C.120 mL | D.140 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com