
| A. | 向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O═2HCO3-+H2SiO3↓ | |
| B. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NH4HCO3溶液中加入足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
分析 A.二氧化碳过量反应生成硅酸和碳酸氢钠;
B.次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子;
C.硝酸具有强的氧化性,能够氧化二价铁离子和硫离子;
D.漏掉氨根离子与氢氧根离子的反应;
解答 解:A.二氧化碳过量反应生成硅酸和碳酸氢钠,离子方程式:SiO32-+2CO2+2H2O═2HCO3-+H2SiO3↓,故A正确;
B.向次氯酸钙溶液中通入少量SO2的离子反应为Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+,故B错误;
C.用稀HNO3溶解FeS固体的离子反应为NO3-+FeS+4H+═Fe3++S↓+NO↑+2H2O,故C错误;
D.向NH4HCO3溶液中加入足量Ba(OH)2溶液,离子方程式:NH4++HCO3-+Ba2++2OH-═BaCO3↓+H2O+NH3•H2O,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确发生反应的实质及离子方程式书写 方法是解题关键,注意反应物用量对反应的影响,题目难度中等.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:选择题
| A. | 只含有1个双键的直链有机物 | B. | 含2个双键的直链有机物 | ||
| C. | 含1个双键的环状有机物 | D. | 含一个叁键的直链有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中水的离子积常数(KW)随溶液浓度的改变而改变 | |
| B. | 一般情况下,一元弱酸HA的Ka越大,表明该酸的酸性越弱 | |
| C. | 对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 | |
| D. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法的名称为2-甲基-3,5-二乙基乙烷 | |
| B. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH,苯、硝基苯四种物质 | |
| C. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加 | |
| D. | 下列物质的沸点按由低到高顺序为:CH3(CH2)2CH3<(CH3)3CH<CH3(CH2)3CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应选用球形分液漏斗进行分液,使用前要检查是否漏水 | |
| B. | 将混合液倒入分液漏斗,塞紧玻璃塞,上下振荡 | |
| C. | 混合液摇匀后,立即将分液漏斗放在铁圈上静置,分层 | |
| D. | 打开分液漏斗的玻璃塞,再打开旋塞,使下层液体从分液漏斗下端放出,待下层液体完全流出后关闭旋塞,把上层液体从分液漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、Cl-、CO32- | B. | Fe2+、Al3+、NO3-、SO42- | ||
| C. | Mg2+、NH4+、CO32-、H+ | D. | Na+、Br-、ClO-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
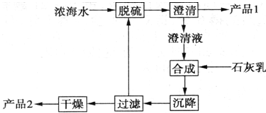 将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品.
将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
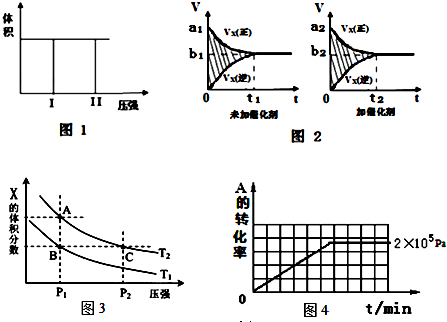
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com