
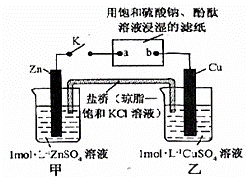
将右图所示实验装置,下列判断正确的是( )
|
| A. | 电子沿Zn→a→b→Cu路径流动 |
|
| B. | 铜电极上发生氧化反应 |
|
| C. | 盐桥中的K+向甲烧杯移动 |
|
| D. | 片刻后可观察到滤纸a点变红色 |
考点:
原电池和电解池的工作原理.
专题:
电化学专题.
分析:
甲、乙装置能自发的进行氧化还原反应,所以是原电池,锌易失电子作负极,铜作正极,则含有硫酸钾溶液的滤纸是电解池,a是阴极,b是阳极,阴极上氢离子放电,阳极上氢氧根离子放电,电子从负极沿导线流向电解池阴极,原电池放电时,阴离子向负极移动,阳离子向正极移动,盐桥中 离子移动式依据溶液中电荷守恒分析判断.
解答:
解:甲、乙装置能自发的进行氧化还原反应,所以是原电池,锌易失电子作负极,铜作正极,则含有硫酸钾溶液的滤纸是电解池,a是阴极,b是阳极,
A.电子从Zn→a,b→Cu路径流动,电子不进入电解质溶液,故A错误;
B.铜电极上铜离子得电子发生还原反应而生成铜,故B错误;
C.锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,盐桥中氯离子移向负极,铜做正极,溶液中铜离子得到电子生成铜,盐桥中K+离子移向乙烧杯,故C错误;
D.电解池中,a电极上氢离子放电生成氢气,同时a电极附近生成氢氧根离子,导致溶液碱性增强,所以a极变红色,故D正确;
故选:D.
点评:
本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,注意电子不进入电解质溶液,电解质溶液是通过阴阳离子的定向移动形成电流,为易错点.


科目:高中化学 来源: 题型:
下列实验操作正确的是( )
A.不慎将浓硫酸沾到皮肤上,立即用大量水冲洗
 B.在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热
B.在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热
C.先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称量
D.过滤时,慢慢地将液体直接倒入过滤器中
查看答案和解析>>
科目:高中化学 来源: 题型:
共价键、离子键和范德华力都是微粒间的作用力,下列物质:①Na2O2;②SiO2;③石墨;④金刚石;⑤CaCl2;⑥白磷,含有上述结合力中的两种的组合是( )
|
| A. | ①③⑤⑥ | B. | ①③⑥ | C. | ②④⑥ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
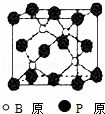
磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.
回答下列问题:
(1)上述反应物中含有一种元素,其基态原子具有八种不同能量电子,写出其基态原子的价电子轨道表示式.
(2)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子.
(3)磷化硼的晶体类型是 ,B原子的杂化方式是 ,每生成1molBP,共形成 4 molB﹣P键.
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P B (填“>”、“<”)
(5)BBr3分子中,B原子采取 杂化,键角为
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方法中可以说明2HI(g)⇌H2(g)+I2(g)已达到平衡的是( )
|
| A. | c(HI):c(H2):c(I2)=2:1:1时 |
|
| B. | 温度和体积一定时,混合气体的颜色不再改变 |
|
| C. | 单位时间内生成n mol H2的同时消耗2n mol HI |
|
| D. | 温度和体积一定时,容器内压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下纯水中c(H+)=10﹣6mol/L,此温度下pH=5的盐酸与pH=9的氢氧化钡溶液混合后pH=7,则氢氧化钡溶液与盐酸之比为( )
|
| A. | 2:99 | B. | 1:1 | C. | 1:99 | D. | 1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:
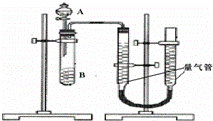
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
某同学进行实验,实验装置如右图.其中A、B的成分见下表
| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是 .
(2)实验开始前需要检查气密性,其操作是 分液漏斗中A溶液应该 一次性 加入(填“一次性”或“逐滴滴加”).
(3)完成该实验还需要 (填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平,其作用是 .
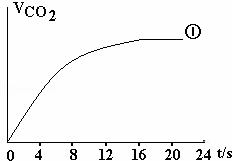
(4)请在框图中,画出实验②、③中CO2体积随时间变化的预期结果示意图.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率.
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | ﹣﹣﹣ |
(5)X= ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 .
(6)2号反应中,H2C2O4的反应速率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质:①O2 ②三氯甲烷 ③CH3CH2CH2OH ④O3 ⑤CHCl3 CH3OCH2CH3 ⑦ C ⑧CH3CH(OH)CH3 ⑨
C ⑧CH3CH(OH)CH3 ⑨ C ⑩CH3OH.
C ⑩CH3OH.
其中属于同系物的有 (填序号,下同),
互为同分异构体的有 ,
互为同素异形体的有 ,
属于同位素的有 ,
是同一种物质的有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:储氢释氢NaHCO3+H2 HCOONa+H2O下列有关说法正确的是( )
HCOONa+H2O下列有关说法正确的是( )
|
| A. | 储氢、释氢过程均无能量变化 |
|
| B. | NaHCO3、HCOONa均含有离子键和共价键 |
|
| C. | 储氢过程中,NaHCO3被氧化 |
|
| D. | 释氢过程中,每消耗0.1molH2O放出2.24L的H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com