
分析 (1)处于中间价态的微粒既有氧化性,也有还原性;
(2)维生素C可使食物中的Fe3+转化为Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高;
(3)由Fe2+$?_{②}^{①}$ Fe3+可知,在过程①中Fe2+元素的化合价升高,在过程②中Fe3+元素的化合价降低;
(4)铁粉在人体胃酸(主要成分时盐酸)的作用下转化成氯化亚铁和氢气;
(5)根据方程式中化合价的变化判断;催化剂在反应前后质量不变,性质不变;
(6)Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,反应中N元素化合价降低,当4molHNO3参加反应时,有1mol被还原,表现为氧化性,3molHNO3表现为酸性.
解答 解:(1)+2价为Fe元素的中间价态,所以亚铁离子既有氧化性,也有还原性,故答案为:B;
(2)维生素C可使食物中的Fe3+转化成Fe2+,Fe元素的化合价降低,所以Fe3+ 是氧化剂,维生素C是还原剂,则维生素C具有还原性,
故答案为:Fe3+;还原;
(3)由Fe2+$?_{②}^{①}$ Fe3+可知,在过程①中Fe2+元素的化合价升高,所以①反应中的Fe2+发生氧化 反应,在过程②中Fe3+元素的化合价降低,则②反应中的Fe3+被还原;故答案为:①氧化;②还原;
(4)铁粉在人体胃酸(主要成分时盐酸)的作用下转化成亚铁盐,反应化学方程式为:Fe+2HCl═FeCl2+H2↑,离子方程式为:Fe+2H+═Fe2++H2↑,故答案为:Fe+2HCl═FeCl2+H2↑;Fe+2H+═Fe2++H2↑;
(5)H2O2+2Fe3+═2Fe2++O2↑+2H+,氧元素从-1价升高到0价,所以生成1mol O2转移电子的物质的量为2mol;反应①、②的总反应方程式为 2H2O2═2H2O+O2↑,Fe3+在反应前后质量不变,性质不变,所以是催化剂,
故答案为:2mol;2H2O2═2H2O+O2↑;催化剂;
(6)Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,反应中N元素化合价降低,当4molHNO3参加反应时,有1mol被还原,表现为氧化性,3molHNO3表现为酸性,则反应中硝酸既表现了氧化性又表现了硝酸的酸性;毎有1molFe参加反应转移电子1mol×(3-0)=3mol;
故答案为:氧化;酸;3.
点评 本题考查氧化还原反应的相关内容,明确反应中元素的化合价变化结合氧化还原反应即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/L的HCl溶液中所含氯化氢分子数为NA | |
| B. | 标准状况下,22.4LSO3所含分子数为NA | |
| C. | 1mol 过氧化钠中阴离子所带电荷数为2NA | |
| D. | 0.1molCl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰火的五彩缤纷是某些金属元素物理性质的展现 | |
| B. | PM2.5是指大气中直径接近2.5×l0-6m的颗粒物,分散在空气中形成胶体 | |
| C. | 石英用于生产光导纤维和计算机芯片 | |
| D. | 食盐、次氯酸钠溶液均可以将某些病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④ | C. | ②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O含有10NA个质子 | |
| B. | 7.8 g Na2O2中含有的阴离子数是0.2NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
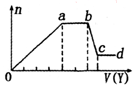 某无色稀溶液X中,可能含有如表所列离子中的某几种.取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示.下列说法正确的是( )
某无色稀溶液X中,可能含有如表所列离子中的某几种.取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示.下列说法正确的是( )| 阴离子 | CO32-、SiO32-、[Al(OH)4]-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则X中一定含有CO32-、SiO32-、[Al(OH)4]-和NH4+ | |
| B. | 若Y是NaOH溶液,则X中一定含有A13+、Fe3+、NH4+、Cl- | |
| C. | 若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-═NH3↑+H2O | |
| D. | 若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+物质的量之比为2:1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
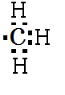 ;
;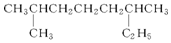 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟利昂或NO2都可破坏臭氧层而导致“温室效应” | |
| B. | 蜂蚁蜇咬人的皮肤时,会将分泌物甲酸注入人体,使人感到疼痛难忍,涂抹稀氨水或者碳酸氢钠溶液可以减轻疼痛 | |
| C. | 向燃料煤中加入生石灰,可减少对大气的污染 | |
| D. | 热水瓶中的水垢的主要成分是CaCO3和Mg(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com