
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下:
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如图所示,过滤操作中的一处错误是 。
判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。
(3)在25℃下,向浓度均为0.01 mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式______________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]="3×10" -34。)
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
装置B中盛放饱和NaCl溶液,该装置的主要作用是 ;F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 _。
(5)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
(1) 2 Al(OH)3+Mg (OH)2 = MgAl2O4 + 4H2O
(2) 漏斗下端尖嘴未紧贴烧杯内壁 AgNO3溶液(或硝酸酸化的AgNO3溶液);坩埚
(3) Al(OH)3 Al3++ 3NH3·H2O=Al(OH)3+ 3NH4+
(4) 除去HCl;吸收水蒸气;碱石灰(或NaOH与CaO混合物)
(5) 4.00g
解析试题分析:(1)根据流程图可知:制备MgAl2O4过程中,高温焙烧时发生反应的物质为Al(OH)3和Mg (OH)2,化学方程式为2 Al(OH)3+Mg (OH)2 = MgAl2O4 + 4H2O;
(2)过滤操作的要点是“一贴”、“二低”、“三靠”,该装置的错误是漏斗下端尖嘴未紧贴烧杯内壁;由流程知沉淀表面含有的杂质离子为NH4+和Cl-,检验沉淀是否洗净,可检验最后一次洗涤液是否含有Cl-,试剂为硝酸酸化的AgNO3溶液,固体的灼烧应在坩埚中进行;
(3)根据25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]="3×10" -34,当Mg2+和Al3+浓度均为0.01 mol?L-1时,生成Mg(OH)2沉淀时所需OH-最小浓度大于生成Al(OH)3沉淀时所需OH-最小浓度,故先生成Al(OH)3沉淀,离子方程式为Al3++ 3NH3·H2O=Al(OH)3+ 3NH4+
(4)本实验的目的是制备无水AlCl3。结合题给装置图可知实验原理为:2Al+3Cl2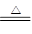 2AlCl3,题给信息“无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾”,所以制备过程要防止水蒸气的干扰。装置图中A为氯气的发生装置,B用来除去氯气中的氯化氢,应加饱和NaCl溶液,C中盛放浓硫酸除氯气中的水蒸气,F装置中盛浓硫酸用于防止外界空气中的水蒸气进入反应装置,G为氯气尾气处理装置,F和G装置可用一个装有碱石灰的干燥管或U形管来代替;
2AlCl3,题给信息“无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾”,所以制备过程要防止水蒸气的干扰。装置图中A为氯气的发生装置,B用来除去氯气中的氯化氢,应加饱和NaCl溶液,C中盛放浓硫酸除氯气中的水蒸气,F装置中盛浓硫酸用于防止外界空气中的水蒸气进入反应装置,G为氯气尾气处理装置,F和G装置可用一个装有碱石灰的干燥管或U形管来代替;
(5)该小题属于计算题。分析题意知:在反应过程中Mg和Cu均失两个电子生成Mg2+和Cu2+,Mg2+和Cu2+都与两个OH-反应生成Mg(OH)2和Cu(OH)2,即Mg和Cu失电子的物质的量和结合OH-的物质的量相等,又HNO3被还原为NO,生成1molNO得3mol电子。现收集到还原产物NO气体0.896L(标准状况),0.04mol,则得电子的物质的量为0.12mol,根据上述分析和电子守恒得Mg2+和Cu2+结合OH-的物质的量为0.12mol,其质量为2.04g,根据质量守恒定律知生成Mg(OH)2和Cu(OH)2沉淀的质量为4.00g。
考点:以无机工艺流程为载体考查化学方程式的书写、化学实验和相关计算


科目:高中化学 来源: 题型:实验题
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下: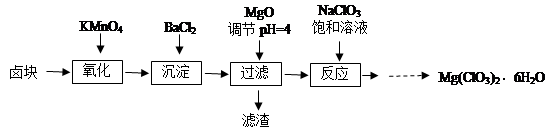
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S )随温度(T )变化曲线如图所示。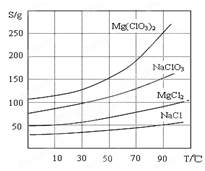
(1)过滤所需要的主要玻璃仪器有 。
(2)加入BaCl2的目的是 ,加MgO后过滤所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7 溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
①写出步骤2中发生反应的离子方程式: ;
②产品中Mg(ClO3)2·6H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组拟探究在含Mg2+、Al3+ 的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程。
【实验】在0.1 mol?L-1 MgSO4、0.05 mol?L-1Al2(SO4)3的混合溶液中滴加0.5 mol?L-1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示。
(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于 (填仪器名称)中滴加。
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是 。
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,小组同学做出如下推测,请补充推测2和3:
推测1:生成Mg(OH)2沉淀,消耗OH-;
推测2: ;
推测3: 。
若推测1符合实际情况,则a点之前反应的离子方程式为 ,请据此描述Mg(OH)2、Al(OH)3两种物质在水溶液中溶解性的差异 。
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
| 较大量存在的含金属元素的离子 | 检验方法 |
| | |
| | |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物。(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。请回答下列问题: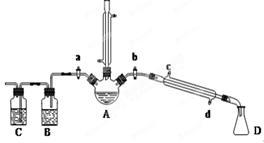
(1)仪器D的名称是 。
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。写出该反应的化学方程式 。
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等。熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是 、 。
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为 ,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气。
(5)相关有机物的数据如下:
| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式: 。
(2)上图装置中NaOH溶液的作用是_ 。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有___ _(填写化学式)。
(3)步骤二中,水浴加热所需仪器有__ _、_ (加热、夹持仪器、石棉网除外);
(4)步骤二的滤液中可能含有CO32-,写出检验CO32-的方法:
(5)影响产品产量的主要因素有__ __。
(6)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
(1)判断BaCl2已过量的方法是 。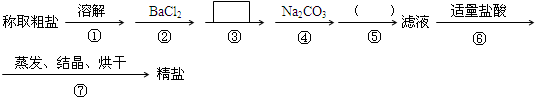
(2)第④步中,写出相应的离子方程式: ; ____________________________.
(3)在 中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
(4)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。)原因是:_______________________ _______ _________________;
步骤③和④可否颠倒____________。
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
【材料一】苏教版《化学1(必修)》工业上从海产品(海带)中获取碘的流程图如下:
(1)上述生产流程的第一步是“浸泡”,它的实验目的是 ;
(2)“氧化”这一操作中可供选用的试剂:Cl2、Br2、浓硫酸和H2O2(滴加稀硫酸),从无污染角度考虑,请你选择的合适试剂 ;
(3)上述的生产流程中,“提纯获得单质碘”一般认为经历两步,你认为应选择下图实验装置分别是( )( ) (按操作的先后顺序填写);


 【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
(4)实际工业生产中,酸化、氧化的方法是先加入硫酸酸化,使pH降低到2,然后加入次氯酸钠一类的氧化剂,使碘离子氧化。工业通常不用氯气氧化原因是(用离子方程式表示)
;
(5)上述的生产流程中离子交换树脂是用碱性树脂吸附,再用亚硫酸钠一类还原剂解吸,请问树脂吸附的碘元素状态是 (填写“游离态”或“化合态”)。解吸后应加入 (填写下列编号:A.氧化剂、B.还原剂)可以实现碘析。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2 ? 2H2O)。
(1)为了完成步骤I,可采用如下图所示的装置将粗铜转化为固体a。
在该实验中,加热A、C装置中的酒精灯时,应该先点燃_______装置的酒精灯,D装置的作用是
_______,C装置中生成的产物是_______。
(2)步骤II中的操作是:将步骤I中的固体加入到容器中,然后加入_______,固体完全溶解。
(3)步骤III中加入的试剂是H2O2,其目的是提高最终制备的氯化铜晶体的纯度,试写出有关反应的离子方程式______________。
(4) 步骤IV中应先加入某试剂,然后过滤得到滤液。为了调节溶液的pH只使Fe3+完全沉淀,加入的试剂是CuO粉末而不用氨水或NaOH溶液,其理由是_______。
(5)步骤V中,将溶液蒸发浓缩、冷却结晶、过滤得到CuCl2·2H2O晶体。现欲得到无水CuCl2,在实验室也可以采用上述装置完成CuCl2 ? 2H2O脱水得到无水CuCl2,则A装置中的两种化学试剂是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学从报刊上了解到菠菜中富含可溶性草酸盐和碳酸盐,决定用实验验证这一事实并检测草酸盐含量。进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元有机酸,还是一种还原性较强的物质,如2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,草酸钙(CaC2O4)不溶于水和醋酸,能溶于强酸:CaC2O4+2H+= H2C2O4+Ca2+。
(1)设计实验方案验证菠菜中含有草酸盐和碳酸盐,补充完成实验步骤、预期现象和结论。
限选试剂:1 mol·L-1 H2SO4、1 mol·L-1 HCl、0.1 mol·L-1 NaOH、1 mol·L-1 CaCl2、0.01 mol·L-1 KMnO4、澄清石灰水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:将菠菜研磨后,浸泡、过滤得到澄清待测溶液。 | |
| 步骤2:调节溶液至弱碱性,滴加足量CaCl2溶液。 | 出现白色沉淀,说明菠菜中可能含有草酸盐和碳酸盐。 |
| 步骤3:取步骤2的沉淀于试管中, | |
| 步骤4: | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com