
【题目】物质结构揭示物质构成的奥秘,请回答以下问题:
(1)元素A含有8个质子,10个中子的核素,用核素符号表示为______。元素B被科学家称“防癌之王”,与元素A同主族位于第四周期,元素B的名称为______,A和B的氢化物,沸点较高的是_____(填化学式)。
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为______。
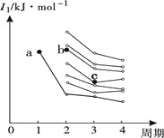
(3)如图是前四周期主族元素第一电离能梯度图,图中a点对应的元素为氢,则b点对应元素的未成对电子数为______,c点对应元素基态原子价电子排布式为_______。
(4)FeC13晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因是____。
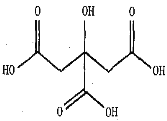
(5)水果中含有不同的果酸,其中柠檬、柑橘等水果中含有柠檬酸,柠檬酸的结构如下图。柠檬酸的晶体类型为_____,碳原子的杂化轨道类型为_____;柠檬酸晶体中含有的作用力有___________。
【答案】![]() 硒 H2O C﹥H﹥Si 2 3s23p2 FeCl3为分子晶体,FeF3为离子晶体,离子晶体的熔点高于分子晶体 分子晶体 sp2、sp3 共价键、氢键、范德华力
硒 H2O C﹥H﹥Si 2 3s23p2 FeCl3为分子晶体,FeF3为离子晶体,离子晶体的熔点高于分子晶体 分子晶体 sp2、sp3 共价键、氢键、范德华力
【解析】
(1)元素A含有8个质子,则为O元素,结合质量数=质子数+中子数,书写原子符号;B与元素A同主族位于第四周期,则B为硒,水分子之间存在氢键,据此判断;
(2)电负性越大,对键合电子吸引越强,元素表现负化合价,据此分析解答;
(3)同周期随原子序数增大,第一电离能呈增大趋势,但IIA族、VA族第一电离能高于同周期相邻元素,结合图示,分析判断出b和c的元素种类再解答;
(4)根据晶体类型与熔沸点的关系分析解答;
(5)柠檬酸属于共价化合物,结合分子的结构示意图分析判断碳原子的杂化方式和存在的作用力。
(1)元素A含有8个质子,则为O元素,且含有10个中子,则质量数为18,故该核素符号为188O;B与元素A同主族位于第四周期,则B为硒,水分子之间存在氢键,而硒化氢之间为范德华力,氢键比范德华力更强,故水的沸点较高,故答案为:188O;硒;H2O;
(2)CH4中共用电子对偏向C,说明C元素电负性更大,SiH4中硅元素为+4价,则H元素电负性比Si的大,故电负性:C>H>Si,故答案为:C>H>Si;
(3)同周期随原子序数增大,第一电离能呈增大趋势,但IIA族、VA族第一电离能高于同周期相邻元素,b处于第二周期,c处于第三周期,由图中第一电离能可知b为O元素、c为Si,O元素外围电子排布为2s22p4,有2个未成对电子,Si原子核外电子排布为:1s22s22p63s23p2,其中价电子排布式为3s23p2,故答案为:2;3s23p2;
(4)FeC13晶体易溶于水、乙醇,用酒精灯加热即可气化,说明FeCl3为分子晶体,FeF3为离子晶体,离子晶体的熔点高于分子晶体,两种化合物熔点差异较大,故答案为:FeCl3为分子晶体,FeF3为离子晶体,离子晶体的熔点高于分子晶体;
(5)柠檬酸的晶体属于分子晶体,羧基中C原子形成3个σ键,其它碳原子形成4个σ键,都没有孤电子对,碳原子杂化方式为:sp2、sp3;柠檬酸分子内存在共价键,分子之间存在范德华力、氢键,故答案为:分子晶体;sp2、sp3;共价键、氢键、范德华力。


科目:高中化学 来源: 题型:
【题目】在标准状况下,将28L HCl气体溶液在水中配成250mL盐酸溶液
(1)求所得盐酸的物质的量浓度;
(2)若取此溶液50mL再稀释成1L溶液,求稀释后盐酸的物质的量浓度;
(3)若用KMnO4氧化该盐酸溶液制氯气,反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,
若产生的Cl2在标准状况下的体积为672mL,则被氧化的HCl的物质的量.(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面对SO2和CO2的描述正确的是
A. SO2为原子晶体,CO2为分子晶体
B. 中心原子采取的杂化方式:SO2为sp2杂化,CO2为sp杂化
C. 都是直线形结构
D. S原子和C原子上都没有孤电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法不正确的是
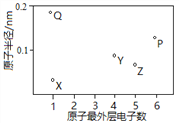
A. X与Q形成的化合物是离子化合物
B. X与Z的原子均含有1个未成对电子
C. Y与P形成的化合物YP2的分子空间构型是直线形
D. Q单质含有金属键,有自由移动的电子,因此可以导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:
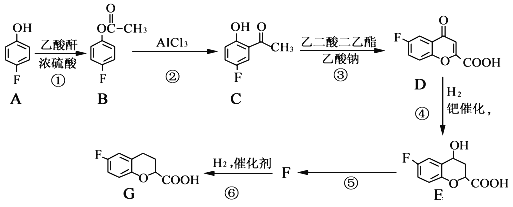
已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)A的名称是______;B中所含的含氧官能团的名称是______.
(2)G的分子式为______.
(3)反应⑤的化学方程式为______,该反应的反应类型是______.
(4)写出一种满足下列条件的E的同分异构体的结构简式:___________.
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.1 mol该物质与足量NaHCO3溶液反应生成2 molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备的
为原料制备的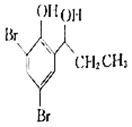 合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br
合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br ![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物,单质铁、砷及它们的化合物广泛应用于超导体材料等领域,请回答下列问题:
(1)Fe2+的核外电子排布式为_________________。
(2)NH3是一种很好的配体,NH3的沸点______(填“>”“=”或“<”)AsH3。
(3)N原子核外有______种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为_____。
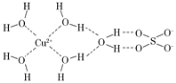
(4)科学家通过X射线测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力为________。
(5)As的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是________________。
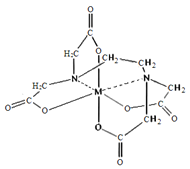
(6)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是_______,Fe3+的配位数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )
X气体 | Y试剂 | Z试剂 | |
A. | NO2 | H2O | H2O |
B. | CO2 | H2O | H2O |
C. | HCl | 饱和食盐水 | 水 |
D. | NO2 和O2 | H2O | H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是N2与H2反应的能量变化曲线图。下列叙述正确的是
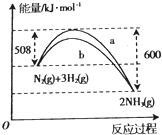
A. 该反应的热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g),△H = +92 kJ/mol
2NH3(g),△H = +92 kJ/mol
B. b曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的反应热减小
D. 加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知反应:R-CH=CH-O-R′(烃基烯基醚) ![]() R-CH2CHO + R′OH
R-CH2CHO + R′OH
烃基烯基醚A的相对分子质量Mr(A)=162,水解产物B的相对分子质量Mr(B)=46。与A相关的化学反应如下,请回答下列问题:
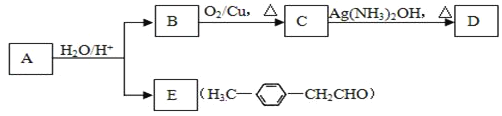
(1)A的结构简式为______________________,该分子中有_________种环境的氢原子。
(2)B的名称是__________,写出B→C反应的化学方程式:________________________。
(3)写出C → D反应的化学方程式:_______________________________________。
(4)写出同时符合下列条件的E的所有同分异构体的结构简式:①属于芳香醛 ②苯环上有两种不同环境的氢原子_________________________。
II.已知: ![]() +ClCH2CH3
+ClCH2CH3 +HCl
+HCl
(5)请写出以![]() 、B和苯作为原料,合成
、B和苯作为原料,合成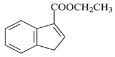 的流程图(注:无机试剂任用)____________________。
的流程图(注:无机试剂任用)____________________。![]()
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com