
分析 两等份溶液中取一份加入含amol氢氧化钠的溶液,发生反应:Mg2++2OH-═Mg(OH)2↓,恰好使镁离子完全沉淀,依据方程式计算镁离子的物质的量;
另取一份加入含bmol氯化钡溶液,发生反应:Ba2++SO42-═BaSO4↓,恰好使硫酸根完全沉淀,依据方程式计算硫酸根离子的物质的量;
溶液呈电中性,每份中存在2n(Mg2+)+n(K+)=2n(SO42-),据此计算钾离子的物质的量,再根据c=
$\frac{n}{V}$计算钾离子浓度.
解答 解:混合溶液分成两等份,每份溶液浓度与原溶液浓度相同,
一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知:
Mg2++2OH-═Mg(OH)2↓,
1 2
n(Mg2+) amol
n(Mg2+)=$\frac{a}{2}$mol;
另一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知:
Ba2++SO42-═BaSO4↓,
1 1
b n(SO42-)
n(SO42-)=b;
由电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),
即2×$\frac{a}{2}$mol+n(K+)=2×b,
n(K+)=(2b-a)mol,
所以C(K+)=$\frac{2b-a}{\frac{V}{2}}$=$\frac{4b-2a}{V}$mol/L;
故答案为:$\frac{4b-2a}{V}$mol/L.
点评 本题考查离子反应的有关混合计算,明确发生的离子反应和溶液中存在的电荷守恒规律是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液pH=12 | B. | 该溶液pH=2 | C. | 该溶液pH=12或2 | D. | 不能确定溶液pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ②③④⑤ | C. | 只有⑤ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液与少量石灰水反应 HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 氯化铵与氢氧化钠两种浓溶液混合加热 NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| C. | 氢氧化镁与稀硫酸反应 H++OH-═H2O | |
| D. | 单质铜与稀硝酸反应 Cu+2H++2NO3-═Cu2++2NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  表示 KNO3 的溶解度曲线,图中 a 点表示的溶液通过升温可以得到 b 点 | |
| B. |  表示某一放热反应,若使用催化剂 E1、E2、△H 都会发生改变 | |
| C. | 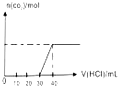 表示向 Na2CO3 和 NaHCO3 的混合溶液中滴加稀盐酸时,产生 CO2 的情况 | |
| D. | 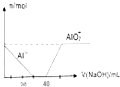 表示向 100mL0.1mol/L 的 AlCl3 和 0.1mol/L 的 NH4Cl 混合溶液中滴加 1mol/L 的 NaOH 溶液时 n(Al3+) 和 n(AlO2-)的变化情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 | |
| B. | 具有固定熔点或沸点的物质一定是纯净物 | |
| C. | 一种离子和一种分子的质子数和电子数不可能同时相等 | |
| D. | 共价化合物溶于水电离过程中,共价键被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
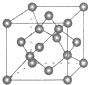 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com