
【题目】可逆反应进行到一定程度时,反应物、生成物浓度均不再改变这是因为
A. 反应停止了B. 某种反应物已完全反应
C. 正反应速率和逆反应速率相等D. 反应物和生成物的物质的量相等
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H2AsO4和单质硫,写出发生反应的化学方程式 _____________________________________________;该反应需要在加压下进行,原因是 _______________________________________
(3)已知:As(s)+3/2H2(g)+2O2(g)=H3AsO4 (s) △H1
H2(g)+1/2O2(g)=H2O(l) △H2
2As(s)+5/2O2(g)=As2O5(s) △H3
则反应As2O5(s)+3H2O(l)=2H3AsO4 (s)的△H= ________________________
(4)298K时,将20mL 3xmol·L-1Na3AsO3、20mL 3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示.
AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示.

①下列可判断反应达到平衡的是 ______ (填标号).
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.c(AsO43-)/c(AsO33-)不再变化 d.c(I-)=ymol·L-1
②tm时,v正______v逆 ( 填“大于”“小于”或“等于”)
③tm时,v逆 ______tn时v逆(填“大于”“小于”或“等于”),理由是 ____________________
④若平衡时溶液pH=14,则该反应的平衡常数K为 ______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4H2O)是一种强还原性的碱性液体,是一种用途广泛的化工原料,实验室用如图装置制备(部分装置省略)。回答下列问题:

(1)步骤1关闭K2、K3,打开K1,制备NaClO;步骤2关闭______,打开_______,通入N2一段时间;关闭K3,打开K2,通入NH3,制备N2H4H2O。
(2)盛放碱石灰的仪器的名称为____________,碱石灰的作用_________________。
(3)步骤2中通入N2一段时间的原因是______________________。
(4)本装置中制备氨气的化学方程式是____________________________。
(5)NH3与NaClO反应生成N2H4H2O的化学方程式为______________________。
(6)已知:N2H4H2O+2I2=N2↑+4HI+H2O,实验室用碘标准溶液测定N2H4H2O粗产品的纯度。若称取N2H4H2O粗产品(其它杂质不与I2反应)2.000g,加水配成250.00mL溶液,移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液,用0.3000molL-1的碘标准溶液进行滴定,碘标准溶液盛放在______(填“酸式”或“碱式”)滴定管中。达到终点的现象是___________。实验测得消耗碘标准溶液的平均体积为20.00mL,则粗产品中水合肼的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“ ZEBRA”绿色电池是新型电动汽车的理想电源,结构如图所示:隔开两极的陶瓷管作钠离子导体。下列关于该电池的叙述错误的是

A. 放电时,Na+、Al3+均向负极移动
B. 放电时,Na元素被氧化
C. 充电时的阳极反应为:Ni+2C1--2e—=NiCl2
D. 该电池具有可快充、高比功率、放电持久等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一桥连三地,天堑变通途。举世瞩目的港珠澳大桥于2018年10月23日正式通车,体现了我国工程建设自主创新能力实现大跨越,尤其在新材料研究方面有重大突破,回答下列问题:
(1)钛是一种新兴的结构材料,比钢轻、比铝硬。
①基态钛原子的价电子排布式为______,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_____种
②钛的硬度比铝大的原因是_______________________________。
③工业上制金属钛采用金属还原四氧化钛。先将TiO2和足量炭粉混合加热至1000~1100K进行氯化处理,生成TiCl4。该反应的化学反应方程式为_______________________。
(2)跨海桥梁的主要结构材料为钢铁。铁能与三氮唑(Bipy,结构见图)形成多种配合物。

①1mol Bipy中所含![]() 键_____mol;碳原子杂化方式是___________________。
键_____mol;碳原子杂化方式是___________________。
②Bipy的沸点为260℃、结构相似且相対分子质量接近的环戊二烯(结构见上图)的沸点为42.5℃.前者较大的原因是______________________________。
(3)碳化钨是耐高温耐磨材料。下图为化晶体的部分结构,碳原子嵌入金属的晶格间隙,并不破坏原有金属的晶格,形成填隙+固溶体、也称为填隙化合物。

①在该结构中,每个钨原子周围距离钨原子最近的碳原子有____个。
②假设该部分晶体的体积为d/cm3,碳化的摩尔质量为Mg/mol,密度为dg/cm3,则阿伏加德罗常数NA用上述数据表示为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下有:a.盐酸 b.硫酸 c.醋酸三种酸溶液.(用序号abc填空)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是__________.
②当其pH相同时,物质的量浓度由大到小的顺序为_________.将其稀释10倍后,pH由大到小的顺序为_____________
(2)某温度下,纯水中的c (H+)= 4.0×10-7 mol/L, 则此温度下纯水中的c (OH-)=______________mol/L; 若温度不变, 滴入稀NaOH溶液, 使c (OH-)= 5.0×10-6 mol/L,则溶液的c (H+)= _________________mol/L.
(3)在25℃时,100ml 1.0mol/L的盐酸与等体积1.2mol/L的氢氧化钠溶液混合, 混合后溶液的pH= _______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器发生下列反应:aA(g)![]() cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. 平衡向正反应方向移动
B. a<c+d
C. D的体积分数增大
D. A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类,如下所示:
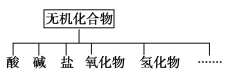
(1)上面所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥处。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②______ | ③______ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出实验室由⑩制备O2的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物结构、性质相关的叙述错误的是
A. 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B. 乙醇分子中含有羟基,能发生氧化反应、取代反应、加成反应。
C. 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
D. 乙烯和苯都能发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com