
【题目】氮化铝(AlN)是一种新型的无机非金属材料,工业上制备原理如下:Al2O3+N2+3C![]() 2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为___________;AlN产品中常含有碳等不与NaOH溶液反应的杂质。为了分析某A1N样品中A1N的含量。某实验小组设计了如下三种实验方案。知:A1N+NaOH+H2O=NaAlO2+NH3↑
2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为___________;AlN产品中常含有碳等不与NaOH溶液反应的杂质。为了分析某A1N样品中A1N的含量。某实验小组设计了如下三种实验方案。知:A1N+NaOH+H2O=NaAlO2+NH3↑
【方案1】有人想用下列A、B两个装置中的一种(在通风橱内进行)。只需进行简单而又必要的数据测定,用差量法就可测定样品中A1N的质量分数,较合理的装置是:___________(填代号)。

【方案2】取一定量(m1)的样品,用以下装置测定样品中A1N的纯度(夹持装置己略去)。

(1)上图C装置中球形干燥管的作用是___________;
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性:再加入实验药品,接下来关闭K1打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间。
请回答:I、需测定___________(填A、B、C)装置反应前后的质量变化。Ⅱ、通入氮气的目的是____________。
【方案3】按以下步骤测定样品中A1N的含量:
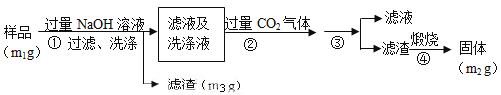
(1)步骤②生成沉淀的离子方程式为___________;
(2)步骤③的操作是___________,A1N的纯度是___________(用m1、m2、m3表示)。
【答案】3:2;
【方案1】B
【方案2】(1)防止倒吸;(2)C;把装置中残留的氨气全部赶入C装置;
【方案3】(1)CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;(2)过滤、洗涤;![]() ×100%
×100%
【解析】
试题分析:(1)氮化铝(AlN)制备:Al2O3+N2+3C![]() 2AlN+3CO,反应中氮元素化合价从0价变化为-3价,做氧化剂被还原为AlN,碳元素化合价从0价变化为+2价,做还原剂被氧化为一氧化碳,所以氧化产物与还原产物的物质的量之比为3:2;故答案为:3:2;
2AlN+3CO,反应中氮元素化合价从0价变化为-3价,做氧化剂被还原为AlN,碳元素化合价从0价变化为+2价,做还原剂被氧化为一氧化碳,所以氧化产物与还原产物的物质的量之比为3:2;故答案为:3:2;
【方案1】装置B较合理,这是通过反应前后总质量减少来测定AlN的质量分数.这里的干燥管作用是吸收被NH3带出来的水蒸气(反应放热,更容易使产生的水蒸气被NH3带走),若用A,则NH3被吸收,反应前后几无质量差,故答案为:B;
【方案2】(1)上图C装置中球形干燥管可以防止倒吸,故答案为:防止倒吸;
(2)组装好实验装置,气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体,打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,故答案为:C;把装置中残留的氨气全部赶入C装置;
【方案3】流程分析可知,样品溶解于过量的氢氧化钠溶液中过滤洗涤,得到滤液和洗涤液中通入过量二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,过滤洗涤得到氢氧化铝固体,煅烧得到氧化铝固体为m2g;
(1)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(2)根据题意,杂质不与氢氧化钠溶液反应,步骤③是过滤洗涤得到氢氧化铝沉淀,煅烧得到氧化铝,测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,Al2O3物质的量=![]() =
=![]() mol,依据铝元素守恒得到样品中铝元素物质的量=n(AlN)=
mol,依据铝元素守恒得到样品中铝元素物质的量=n(AlN)=![]() mol×2=
mol×2=![]() mol,A1N的质量=
mol,A1N的质量=![]() mol×41g/mol=
mol×41g/mol=![]() g,纯度=
g,纯度=![]() g/m1g=
g/m1g=![]() ×100%,故答案为:过滤、洗涤;
×100%,故答案为:过滤、洗涤;![]() ×100%
×100%


科目:高中化学 来源: 题型:
【题目】化学课上,围绕硫的化合物性质进行如下探究,请根据要求回答以下问题。

(1)装置A中反应的化学方程式为________________________________。
(2)装置B用来探究SO2的漂白性,则应装的试剂是________,反应一段时间后,看到的现象是________________;若将Cl2通入B中也能看到同样的现象,则二者在反应原理上________(填“相同”或“不相同”)。
(3)装置C检验SO2具有______性(填“氧化”或“还原”)。装置C试管口棉花团应蘸有_____溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有有机化合物A~E,其转化关系如图所示。

根据以上信息,回答下列问题:
(1)若A为氯代烃,质谱分析测得A的相对分子质量为92.5,且A的核磁共振氢谱图上有三个波峰,其面积之比为1:2:6,则A的结构简式为________,B中所含官能团的名称为________。
(2)请写出下列反应的化学方程式及反应类型。
①A→B:____________________________________________,
反应类型为___________________________________________。
②B+D→E:_________________________________________,
反应类型为__________________________________________。
(3)请写出有机物D的属于酯类的所有同分异构体的结构简式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种化合物,如NH3、N2H4、NH4NO3、NF3等。
(1)已知:N2(g)+2H2(g)═N2H4(l)△H=+50.6kJmol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1
则N2H4(l)+O2(g)═N2(g)+2H2O △H= _________kJmol-1;
(2)污水中的NH4+可以用氧化镁处理,发生如下反应:
MgO+H2O![]() Mg(OH)2Mg(OH)2+2NH4+
Mg(OH)2Mg(OH)2+2NH4+![]() Mg2++2NH3H2O
Mg2++2NH3H2O

①温度对氮处理率的影响如图所示.在25℃前,升高温度氮去除率增大的原因是________________;
②剩余的氧化镁,不会对废水形成二次污染,理由是________________;
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2═2HNO2+2H2O+2H+;2HNO2+O2=2HNO3).然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体.
①上述方法中,14g铵态氮元素转化为硝态氮元素时需氧的质量为_______g。
②写出加入甲醇后反应的离子方程式________________;
(4)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式________________;
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为________________;

(5)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。写出a电极的电极反应式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.某化学兴趣小组用模拟制备氨基甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)△H<0
NH2COONH4(s)△H<0
(1)制备氨基甲酸铵的装置如图1所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是__________________,液体石蜡鼓泡瓶的作用是_____________;
②从反应后的混合物中分离出产品的实验方法是_____________(填写操作名称),为了得到干燥产品,应采取的方法是_____________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
③尾气处理装置如图所示,能否将浓H2SO4改为稀H2SO4_____________(填“能”或“否”),理由是_____;

(2)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000g.则样品中氨基甲酸铵的质量分数为_____________。[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100].
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“关爱生命,注意安全”。惨痛的天津爆炸触目惊心,火灾之后依然火势绵延不绝的原因之一是易燃物中含有电石。工业上常用电石(主要成分为CaC2,杂质为CaS等)与水反应生产乙炔气。
(1)工业上合成CaC2主要采用氧热法。
已知:CaO(s)+3C(s)=CaC2(s)+CO(g) △H=+464.1kJ·mol-1
C(s)+l/2O2(g)=CO(g) △H=-110.5kJ.mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO,为维持热平衡,每生产l molCaC2,转移电子的物质的量为_______。
(2)已知2000℃时,合成碳化钙的过程中还可能涉及到如下反应
CaO(s)+C(s) ![]() Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+2C(s) ![]() CaC2(s) K2 △H2=b KJ·mol-1
CaC2(s) K2 △H2=b KJ·mol-1
2CaO(s)+CaC2(s) ![]() 3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
则K1=_______ (用含K2、K3的代数式表示);c=_____(用含a、b的代数式表示)。
(3)利用电石产生乙炔气的过程中产生的H2S气体制取H2,既廉价又环保。

①利用硫化氢的热不稳定性制取氢气。在体积为2L的恒容密闭容器中,H2S起始物质的量为2mol,达到平衡后H2S的转化率![]() 随温度和压强变化如图l所示。据图计算T1℃时压强P1时,硫为气态,则平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是______。
随温度和压强变化如图l所示。据图计算T1℃时压强P1时,硫为气态,则平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是______。
②电化学法制取氢气的原理如图2,请写出反应池中发生反应的离子方程式_____,惰性电极a上发生的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是由甲苯为起始原料的一系列变化,请填写下列空白:
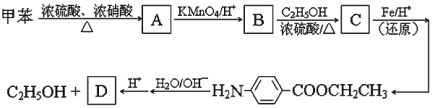
⑴ 写出化合物 B 的结构简式: 。
⑵ 由 B 到 C 的反应类型是 。
⑶ 任意写出两种同时符合下列要求的化合物 C 的同分异构体的结构简式(E、F、G 除外)。
① 化合物是1,4-二取代苯,其中苯环上的一个取代基是硝基;
② 分子中含有 -COO- 结构的基团。
![]()
![]()
![]()
⑷ E、F、G 中有一种化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,这种化合物是 (在 E、F、G 中选择,填字母)。
⑸ 一定条件下,化合物 D 发生聚合反应的化学方程式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分见下图,相关物质的沸点见附表)。

附表相关物质的沸点(101kPa)

步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,_________________。
步骤3:有机相用10%NaHCO3溶液洗涤,再加入适量无水MgSO4固体,放置一段时间后过滤;
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中可能的错误有______________,冷凝管进水口是______________;
(2)有同学建议将装置中温度计换成搅拌棒,那么温度计应移到什么地方使用______________;
(3)步骤2后续操作是_____________;
(4)步骤3中用10%NaHCO3溶液洗涤的具体操作是____________________,加入无水MgSO4固体的作用是______________。
(5)步骤4中采用蒸馏分离,请你预测蒸馏温度应先选择约_______℃,再选择约_______℃。
A.50 B.100 C.150 D.200 E.250 F.300
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列各小题实验.(a、b为弹簧夹,加热及固定装置已略去)

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
① 实验步骤:连接仪器、 、加药品后,打开a关闭b,然后滴入浓硫酸,加热;
② 铜与浓硫酸反应的化学方程式 ,装置A中的试剂是 ;
③ 能说明碳的非金属性比硅强的实验现象是 ;
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)②操作后打开b,关闭a ;
② H2S溶液中有浅黄色浑浊出现,化学方程式是 ;
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表中相应位置。

写出其中SO2显示还原性生成沉淀的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com