
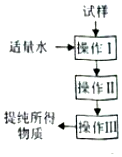
 实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )
实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )| A. | 操作I一定是过滤,其目的是将固液分离 | |
| B. | 可以提纯含少量氧化铁杂质的氧化铝 | |
| C. | 可以提纯含少量氯化钠杂质的硝酸钾 | |
| D. | 可以提纯含少量碘杂质的氧化钠 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.| X | Y | |
| Z | W |
 ;W最高价氧化物的水化物的化学式:HClO4.
;W最高价氧化物的水化物的化学式:HClO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| B | 将SO2气体通入紫色石蕊溶液中,观察溶液颜色的变化 | 能证明SO2具有漂白性 |
| C | 向2mL1mol•L-1NaOH溶液中先加入0.2mL1mol•L-1FeCl3溶液,再加入0.2mL1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴“84”消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,“84”消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
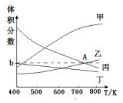
| t/min | 0 | 1 | 3 | 5 |
| N(H2)/mol | 8 | 6 | 5 | 5 |
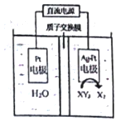
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
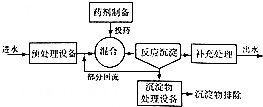
| 污水中所含离子 | H+、OH- | CN- | Cu2+、Hg2+ |
| 处理方法 | 中和法 | 氧化还原法 | 沉淀法 |
| 物质 | Cu(OH)2 | CuS | FeS | PbS | HgS | CdS |
| Ksp | 2.2×10-20 | 8.5×10 -45 | 6.3×10 -18 | 3.4×10-28 | 4×10-53 | 8×10-29 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
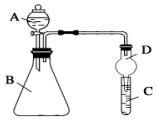 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com