
 .
. .
.分析 X、Y、Z、W四种均为短周期元素,Y的气态氢化物与W的气态氢化物相遇有白烟生成,则一种是氨气、一种是HCl,Y能形成-1价阴离子,则Y是Cl元素、W是N元素;Z+与W的气态氢化物分子具有相同的电子式,则Z是Na元素;X 2-、Y-与Y的气态氢化物分子具有相同的电子数,则X是S元素,S在空气中燃烧产生气体SO2,所以R为SO2,
(1)S2-离子核外有3个电子层、最外层电子数是8,据此书写其离子结构示意图;
(2)元素Z为Na,Na在空气中燃烧生成淡黄色的过氧化钠;
(3)W的氢化物为氨气,实验室利用铵盐与碱加热制备;
(4)Y为Cl元素,R为SO2,氯气和二氧化硫在水溶液里发生氧化还原反应生成硫酸和盐酸.
解答 解:X、Y、Z、W四种均为短周期元素,Y的气态氢化物与W的气态氢化物相遇有白烟生成,则一种是氨气、一种是HCl,Y能形成-1价阴离子,则Y是Cl元素、W是N元素;Z+与W的气态氢化物分子具有相同的电子式,则Z是Na元素;X 2-、Y-与Y的气态氢化物分子具有相同的电子数,则X是S元素,S在空气中燃烧产生气体SO2,所以R为SO2,
(1)S2-离子核外有3个电子层、最外层电子数是8,其离子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)元素Z为Na,Na在空气中燃烧生成淡黄色的过氧化钠,其电子式为 ,
,
故答案为: ;
;
(3)W的氢化物为氨气,实验室利用铵盐与碱加热制备,化学反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)Y为Cl元素,R为SO2,氯气和二氧化硫在水溶液里发生氧化还原反应生成硫酸和盐酸,离子方程式为Cl2+SO2+2H2O=4H++SO42-+2Cl-,
故答案为:Cl2+SO2+2H2O=4H++SO42-+2Cl-.
点评 本题考查位置结构性质的相互关系及应用,为高频考点,把握白烟为氯化铵为推断的关键,注意元素化合物知识及化学用语的使用,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
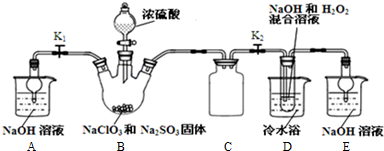
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是碱性氧化物 | |
| B. | Na2O2中阴阳离子个数比为1:1 | |
| C. | 可用澄清石灰水来区分Na2CO3 和NaHCO3 | |
| D. | 与同浓度盐酸反应的剧烈程度:NaHCO3>Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.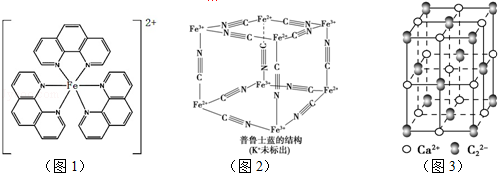
 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com