
| A. | 化学是以实验为基础的一门学科,定量研究方法是化学发展为一门独立学科的重要标志之一 | |
| B. | 燃煤脱硫、汽车中加装尾气处理装置、利用二氧化碳制造全降解塑料、推广新能源汽车都能有效减少环境污染 | |
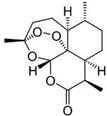
| C. | 我国科学家屠呦呦发现的青蒿素(结构见图),其中有类似于H2O2的结构,因此遇到强还原性的物质会变质 | |
| D. | 利用氢氧化铁胶体的“丁达尔效应“,可以除去水中的悬浮颗粒,从而达到净水的效果 |
分析 A.化学是一门以实验为基础的自然科学,它的基础就是实验;
B、煤中加入生石灰减少二氧化硫的排放,汽车中加装尾气处理装置减少一氧化碳和一氧化氮的排放;利用二氧化碳制造全降解塑料能减少白色污染;
C、青蒿素结构中存在过氧键,具有强氧化性;
D、氢氧化铁胶体常用于净水是因为具有吸附性,能吸附水中悬浮颗粒并沉降.
解答 解:A.化学是以实验为基础的一门学科,可进行定性、定量实验分析,而定量研究方法是化学发展为一门学科的重要标志,故A正确;
B、煤中加入生石灰减少二氧化硫的排放,汽车中加装尾气处理装置减少一氧化碳和一氧化氮的排放;利用二氧化碳制造全降解塑料能减少白色污染,三者都能有效减少环境污染,故B正确;
C、青蒿素结构中存在过氧键,具有强氧化性,所以遇到强还原性的物质发生氧化还原反应而变质,故C正确;
D、氢氧化铁胶体具有吸附性,能吸附水中悬浮颗粒并沉降,常用于净水,而不是丁达尔效应,故D错误;
故选D.
点评 本题主要考查了物质的组成、性质、污染物的处理方法以及有机物结构与性质的关系,难度不大,注意知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 碘酒是指单质碘的乙醇溶液 | |
| B. | 化合反应均为氧化还原反应 | |
| C. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| D. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 | 0.1MPa | 0.5MPa | 1MPa | 1.5MPa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | A的转化率增大 | ||
| C. | D的体积分数增大 | D. | a+b<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 标准状况下,11.2 LNO与11.2LO2混合后所含分子数为0.75NA | |
| C. | Na2O和Na2O2混合物的物质的量为1mol,其中含有的阴离子总数为NA | |
| D. | 室温下,将9g铝片投入0.5L18.4mol•L-1的H2SO4中,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com