
| A. | 离子化合物一定含有离子键 | |
| B. | 共价化合物一定不含离子键 | |
| C. | 只含共价键的物质叫共价化合物 | |
| D. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 |
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:解答题
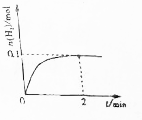 一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol
一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
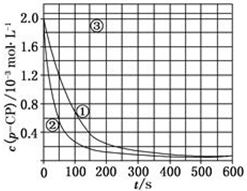 [数据处理]实验测得p-CP的浓度随时间变化的关系如图:
[数据处理]实验测得p-CP的浓度随时间变化的关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 足量硫酸铝与纯碱反应:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 向Ba(OH)2溶液中加入少量NaHSO3溶液:2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
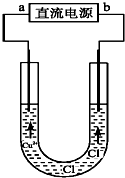
| A. | a端是直流电源的负极 | |
| B. | 阴极附近Cu2+浓度增大 | |
| C. | 阳极有铜析出 | |
| D. | 通电一段时间后,在阴极附近观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com