
| 3 |
| 2 |

| △c |
| △t |
| (1-0.25)mol/L |
| 10min |
| 0.75 |
| 0.25×0.5×0.5 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
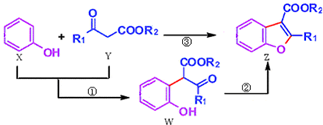
| A、反应①属于加成反应 |
| B、X分子式为C6H6O |
| C、X、Y、W、Z都能与NaOH溶液反应 |
| D、可用溴水或FeCl3溶液鉴别X和W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2A (l)+B (l)=2C (g)△H1 |
| B、2A (g)+B (g)=2C(g)△H2 |
| C、2A (g)+B (g)=2C (l)△H3 |
| D、2A (l)+B (l)=2C(l)△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化碳溶于水可以导电,所以二氧化碳属于电解质 |
| B、在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
| C、只有酸碱盐才是电解质 |
| D、纯净的电解质在液态时,有的导电,有的不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制氢气时用粗锌比用纯锌放出氢气快 |
| B、镀锌铁(在铁上镀一层锌)比镀锡铁耐腐蚀 |
| C、铝制门窗不用涂刷油漆 |
| D、轮船水线以下的船壳上装一定数量的锌块 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管用蒸馏水洗后未用标准液润洗就装标准液滴定 |
| B、锥形瓶未用待测液润洗 |
| C、读取标准液读数时,滴前仰视,滴定到终点后俯视 |
| D、滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com