
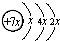 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: .
. 分析 A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,则C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素.
解答 解:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,则C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素.
(1)由上述分析可知,A为Si,B为Na元素,C为P元素,D为N元素,
故答案为:Si;Na;P;N;
(2)元素的非金属性越强,则最高价氧化物对应水化物酸性越强,则酸性最强的是HNO3,碱性最强的是NaOH,
故答案为:HNO3;NaOH;
(3)D所在周期为第二周期,同周期自左而右电负性增大、第一电离能呈增大趋势(稀有气体除外),故第一电离能最大为F,电负性最大为F,
故答案为:F;F;
(4)D的氢化物为NH3,C的氢化物为PH3,因为氨气分子间能形成氢键,使氨气的沸点升高,沸点高于PH3的,
故答案为:高;NH3分子间形成氢键;
(5)E为Fe元素,原子序数为26,位于周期表第四周期第Ⅷ族,
故答案为:26;第四周期第Ⅷ族;
(6)A、B、C最高价氧化物分别为SiO2O、Na2O、P2O5,晶体类型分别是原子晶体、离子晶体、分子晶体,
故答案为:原子;离子;分子;
(7)D是N元素,核外电子排布式为1s22s22p3,其核外电子排布图为: ,
,
故答案为: .
.
点评 本题考查元素推断、元素周期律、核外电子排布规律、氢键等,推断元素是解题的关键,熟练掌握元素周期律,注意同周期主族元素中第一电离能异常情况.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入NaHCO3溶液产生气体,表示含有-COOH或酚羟基 | |
| B. | 遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质 | |
| C. | 加入新制的Cu(OH)2悬浊液,加热煮沸有红色沉淀生成,或加入银氨溶液加热有银镜生成,表示含有-CHO | |
| D. | 某有机物与醋酸反应,相对分子质量增加42,则含有1个-OH;增加84,则含有2个-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
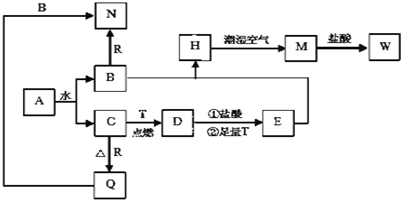
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3一四甲基丁烷 | B. | 2,3,4一三甲基戊烷 | ||
| C. | 3,4一二甲基己烷 | D. | 2,5一二甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4O | C2H6O | C3H8O | x | C5H12O | C6H14O | … |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
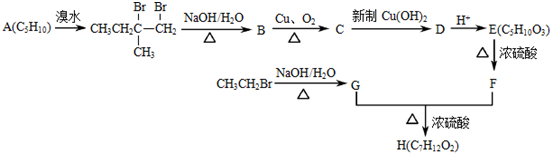
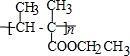 .
.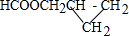 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1mol H2和1mol Cl2 光照或点燃后的产物 | |
| B. | 室温下22.4L HCl气体 | |
| C. | 室温下,将1mol HCl气体通入100mL水中所得溶液 | |
| D. | 室温下,36.5g HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
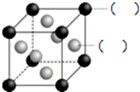 A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得.请回答下列问题:
A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得.请回答下列问题: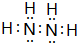 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com