
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
分析 (1)K为生成物浓度幂之积与反应物浓度幂之积的比,纯固体不能列入表达式中;随着温度升高,平衡常数减小,可知升高温度,平衡逆向移动;
(2)提高反应中CO的平衡转化率,可改变条件,平衡正向移动,但不能加CO;
(3)1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,反应经过5min后达到平衡,由表格数据可知K=4.0,则
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
起始量(mol) 2.0 2.0
转化的量(mol) x x
平衡时的量(mol) 2.0-x 2.0+x
结合K计算.
解答 解:(1)K为生成物浓度幂之积与反应物浓度幂之积的比,纯固体不能列入表达式中,则K=$\frac{c(C{O}_{2})}{c(CO)}$;随着温度升高,平衡常数减小,可知升高温度,平衡逆向移动,则正反应为放热反应,
故答案为:$\frac{c(C{O}_{2})}{c(CO)}$;放;
(2)A.减少Fe的量,平衡不移动,故A不选;
B.增加Fe2O3的量,平衡不移动,故B不选;
C.移出部分CO2,平衡正向移动,CO的转化率提高,故C选;
D.加入合适的催化剂,平衡不移动,故D不选;
E.增大容器的容积,平衡不移动,故E不选;
故答案为:C;
(3)设CO转化的物质的量为x,则
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
起始量(mol) 2.0 2.0
转化的量(mol) x x
平衡时的量(mol) 2.0-x 2.0+x
又在1000℃时K=4.0,则有$\frac{2.0+x}{2.0-x}$=4.0,解得x=1.2,
CO2的浓度变化量为c(CO2)=1.2 mol•L-1,
则用二氧化碳表示的反应速率为$\frac{1.2mol}{5min}$=0.24 mol•(L•min )-1,
CO的转化率为$\frac{1.2mol}{2mol}$×100%=60%,
故答案为:0.24 mol•(L•min )-1;60%.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡常数的计算、平衡影响因素、三段法计算格式为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离方程式:H2CO3═2H++CO32- | |
| B. | NaHSO4(溶液)的电离:NaHSO4═Na++H++SO42- | |
| C. | 明矾可用于净水:Al3++3H2O═Al(OH)3↓+3H+ | |
| D. | HCO3-的水解方程式为:HCO3-+H2O═CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
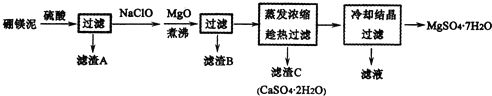
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
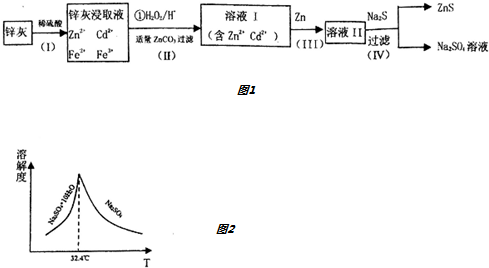
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

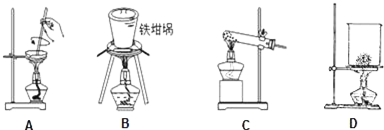
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Y>Z>W>R>X | |
| B. | 氢化物稳定性:X>W>R | |
| C. | Y、Z、W的最高价氧化物对应的水化物两两均可互相反应 | |
| D. | Y与Z不能存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
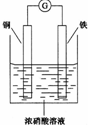 HN03和 HN02是氮的两种重要含氧酸.HN02能被常见的氧化剂(如高锰酸钾、重铬酸钾等)氧化;在酸性条件下也能被亚铁离子、碘离子还原;亚硝酸银( AgN02 )是一种难溶于水、易溶于酸的化合物.回答下列问题:
HN03和 HN02是氮的两种重要含氧酸.HN02能被常见的氧化剂(如高锰酸钾、重铬酸钾等)氧化;在酸性条件下也能被亚铁离子、碘离子还原;亚硝酸银( AgN02 )是一种难溶于水、易溶于酸的化合物.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 AIN是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com