
【题目】[化学——选修3:物质结构与性质](15分)
锌是人体必需的微量元素之一,起着极其重要的作用,回答下列问题:
(1)请写出Zn2+的核外电子排布式_____________________。
(2)ZnCl2熔点为275 ℃,而CaCl2的熔点为782 ℃,请分析熔点不同的原因:_________。
(3)Zn2+能与多种微粒形成配合物,如Zn2+与CNO可形成[Zn(CNO)4]2,[Zn(CNO)4]2中配位原子为__________,[Zn(CNO)4]2的组成中非金属元素的电负性大小顺序为____________;Zn2+与CN可形成[Zn(CN)4]2,[Zn(CN)4]2中σ键、π键和配位键的个数比为________;配合物Zn(NH3)4CO3中阴离子的空间构型为____________,N原子的杂化方式为____________。
(4)Zn与S所形成化合物的晶胞如图1所示,图2为晶胞沿y轴的投影1∶1平面图:

①晶胞中S原子的配位数为_________。
②晶胞中最近的两个S原子之间的距离为_______pm。
③设阿伏加德罗常数的值为NA,则该晶胞的密度是__________g·cm3(列出计算表达式)。
[化学——选修5:有机化学基础](15分)
哌替啶盐酸盐G有镇痛作用,其合成路线如下。回答下列问题:
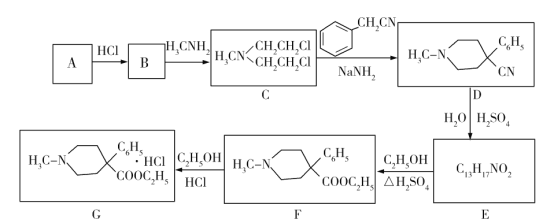
(1)写出A的结构简式:________;B中含有碳碳双键,则B的名称为_____________。
(2)G中含氧官能团名称为____________;B→C的反应类型为_________________。
(3)E的结构简式为_____________。
(4)写出C→D的化学方程式:_______________________________________。
(5)M与E互为同分异构体,符合下列条件的M有______种。
①属于芳香α-氨基酸;
②含有两个六元环。
其中一种同分异构体,—NH2被H原子取代后,除苯基上H原子外,其他核磁共振氢谱的峰面积比为4∶4∶1∶1∶1,该同分异构体的结构简式为______________。
(6)请结合以上合成路线,写出以H3CNHCH2Cl和CH2=CHCl及上述流程中出现的物质为原料合成 的路线______________________。
的路线______________________。
【答案】1s22s22p63s23p63d10(或[Ar]3d10)(1分) CaCl2为典型的离子化合物,而ZnCl2虽为离子化合物,但有明显的共价性(1分) O(1分) O > N >C(1分) 2∶2∶1(2分) 平面三角形(2分) sp3(1分) ①4(1分) ②2a(2分) ③![]() (3分) CH≡CH(1分) 氯乙烯(1-氯乙烯)(1分) 酯基(1分) 加成反应(1分)
(3分) CH≡CH(1分) 氯乙烯(1-氯乙烯)(1分) 酯基(1分) 加成反应(1分) 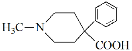 (2分)
(2分) 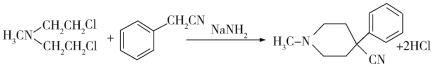 (2分) 3(1分)
(2分) 3(1分)  (2分)
(2分) 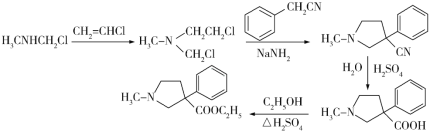 (4分)
(4分)
【解析】
[化学——选修3:物质结构与性质]
(1)Zn的原子序数为30,其核外电子排布式为[Ar]3d104s2,Zn2+是锌原子失去2个电子所形成的,Zn2+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10。
(2)Ca的金属性比Zn的强,Ca、Zn与氯形成CaCl2、ZnCl2,其中CaCl2为典型的离子化合物,熔点比较高,而ZnCl2虽为离子化合物,但因Zn的活泼性比较弱,形成的ZnCl2有明显的共价性,使ZnCl2熔点比CaCl2低。
(3)配位原子必须能提供孤电子对,而CNO结构中,O能提供孤电子对,故配位原子为O原子,[Zn(CNO)4]2中非金属元素为C、N、O,同一周期从左至右,电负性逐渐增大,它们的电负性大小顺序为O> N>C,一个[Zn(CN)4]2中Zn与4个CN间有4个配位键即4个σ键,每个CN之间存在一个σ键和2个π键,σ与π和配位键的个数为8、8、4,比值为 2∶2∶1。Zn(NH3)4CO3中阴离子为![]() ,是平面三角形,NH3中的N是sp3杂化。
,是平面三角形,NH3中的N是sp3杂化。
(4)①根据图可看出每一个S周围有4个Zn,配位数为4。②最近的两个S原子之间的距离是面对角线的一半,根据图2可知面对角线长为4a pm。最近的两个S原子之间的距离是2a pm。③晶胞中Zn的个数为顶点8×![]() =1,面心6×
=1,面心6×![]() =3,共4个,S在内部,共4个,化学式为ZnS,式量为65+32,设晶胞边长为d pm,
=3,共4个,S在内部,共4个,化学式为ZnS,式量为65+32,设晶胞边长为d pm,![]() =4a,d=
=4a,d=![]() ,ρd3NA=4(65+32)span>,ρ =
,ρd3NA=4(65+32)span>,ρ =![]() g·cm3。
g·cm3。
[化学——选修5:有机化学基础]
(1)根据A→B→C,可看出A与HCl和H3CNH2发生连续加成反应,所以A含有碳碳叁键,为乙炔,结构简式为CH≡CH,B中含有碳碳双键,是A与HCl加成所得,所以B为氯乙烯。
(2)根据合成路线可知,G中含氧官能团为酯基,B生成C,发生加成反应。
(3)根据D、F的结构,可知E中含羧基,得出E的结构简式为 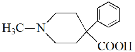 。
。
(4)C生成 D发生了取代反应,方程式为:
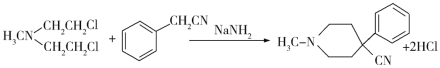 。
。
(5)苯环在1,2,3位时都满足条件,即 ,
, 中—NH2被H代替后为
中—NH2被H代替后为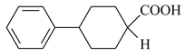 ,除苯环外,其他C原子上的H原子个数如下:
,除苯环外,其他C原子上的H原子个数如下: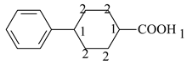 ,核磁共振氢谱峰面积比正好为4∶4∶1∶1∶1。
,核磁共振氢谱峰面积比正好为4∶4∶1∶1∶1。
(6)利用题干B→C→D→E→F的反应原理,B→C为双加成反应,而所设计的合成路线中为单加成反应,题干中C→D和所设计合成路线中一样均为双取代反应,题干中D→E→F与所设计合成路线中一样均为水解、酯化反应,所以合成路线为:


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】工业上制硫酸的一步重要反应是2SO2(g)+O2(g)![]() 2SO3(g),此反应在某条件下的某密闭反应容器中达到化学平衡状态。下列有关说法不正确的是( )
2SO3(g),此反应在某条件下的某密闭反应容器中达到化学平衡状态。下列有关说法不正确的是( )
A.此时,SO2的转化率达到最大程度
B.此时,SO2的消耗速率等于SO2的生成速率
C.此时,SO3的浓度保持不变
D.该反应达到化学平衡状态后反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不发生消去反应的是( )
①![]() ②
②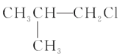 ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A.①③⑥B.②③⑤C.全部D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White),亚甲基蓝的结构简式: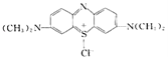
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色,以上③、④可重复多次。
试回答下列问题:
(1)某学生将起初配得的蓝色溶液分装在A,B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色,若再同时振荡A,B试管,能显蓝色的是_________(填“A”或“B”);
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色_________(填“能”或“不能”);若塞紧锥形瓶塞并打开a、b通入足量氧气,溶液能否由无色变为蓝色_________(填“能”或“不能”);
(3)上述转化过程中,葡萄糖的作用是_________,亚甲基蓝的作用是_________;
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有_____;
(5)该实验中③、④操作能否无限次重复进行_________(填“能”或“不能”),理由是 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是位于不同周期的主族元素、原子序数依次增大且均小于18,Z为金属元素,X、Y、Z的最外层电子数之和为8,X、Y、Z组成的物质可发生反应:ZX2+2YX3![]() Z(YX2)2+2X2。下列有关说法正确的是
Z(YX2)2+2X2。下列有关说法正确的是
A.1 mol ZX2发生上述反应转移电子的物质的量为4 mol
B.YX3与Y2X4中Y元素的化合价相同
C.上述反应中的离子化合物的所有元素原子的最外层都满足8电子稳定结构
D.Y元素在同周期和同主族元素的最高价含氧酸中酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生下列反应2A(g) + B(g) ![]() xC(g) + 2D(g),经4min后达平衡,测得D的浓度为1.0 mol·L-1,c(A) : c(B)=2 : 3,以C表示的平均速率υ(C)=0.125 mol·L-1·min-1,下列说法不正确的是
xC(g) + 2D(g),经4min后达平衡,测得D的浓度为1.0 mol·L-1,c(A) : c(B)=2 : 3,以C表示的平均速率υ(C)=0.125 mol·L-1·min-1,下列说法不正确的是
A. 反应速率υ(A)=0.25 mol·L-1·min-1
B. 该反应方程式中,x=1
C. 4 min时,B的物质的量为2 mol
D. 该反应的平衡常数K=1/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜的工艺流程如图:

(1)步骤(Ⅰ)“吹脱”的目的是___(写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的___(填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是___。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为___。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为___,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___。
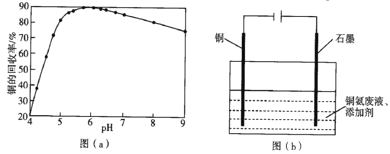
(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为___;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___(填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO45H2O375g,则1L废液中含有铜元素的质量为___g。(保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯反应温度为115~125℃,反应装置如下图。下列对该实验的描述错误的是( )
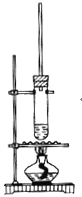
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1-丁醇的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:_________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol·L-1·min-1,则平衡后n(CO)=________mol,关于该平衡的下列说法正确的是________。
a.增大压强,平衡一定向右移动
b.其他条件不变,升高温度,化学反应速率一定增大
c.其他条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.达到平衡后v正(NO)=2v逆(N2)
(3)其他条件相同,t min时不同温度下测得NO的转化率如图所示。

A点的反应速度v正________(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是________(填“A”或“B”)。
(4)已知HNO2的电离常数Ka=7.1×10-4mol·L-1;
NH3·H2O的电离常数Kb=1.7×10-5mol·L-1
则0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是____________________________,
常温下NO2-水解反应的平衡常数Kh=________(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com