
分析 X、Y、Z和W代表原子序数依次增大的四种短周期元素,①元素周期表中,Z与Y相邻,Z与W相邻,可能出现的位置关系有:YZW、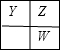 、
、 ;②X分别与Y、Z、W可组成化学式为YX3,X2Z和X2W三种共价化合物,Z、W为同主族元素,Y、Z、W之间的位置关系为
;②X分别与Y、Z、W可组成化学式为YX3,X2Z和X2W三种共价化合物,Z、W为同主族元素,Y、Z、W之间的位置关系为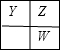 ,所以X应为H,Y为N,Z为O,W为S,据此答题;
,所以X应为H,Y为N,Z为O,W为S,据此答题;
解答 解:X、Y、Z和W代表原子序数依次增大的四种短周期元素,①元素周期表中,Z与Y相邻,Z与W相邻,可能出现的位置关系有:YZW、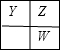 、
、 ;②X分别与Y、Z、W可组成化学式为YX3,X2Z和X2W三种共价化合物,Z、W为同主族元素,Y、Z、W之间的位置关系为
;②X分别与Y、Z、W可组成化学式为YX3,X2Z和X2W三种共价化合物,Z、W为同主族元素,Y、Z、W之间的位置关系为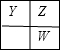 ,所以X应为H,Y为N,Z为O,W为S,
,所以X应为H,Y为N,Z为O,W为S,
(1)X应为H,Y为N,Z为O,X、Y、Z原子最外层电子数之和是1+5+6=12,
故答案为:12;
(2)X2W为H2S,其结构式是H-S-H,
故答案为:H-S-H;
(3)X、Y和Z组成的一种化合物是强酸应为HNO3,HNO3的稀溶液与铜反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,含Y、Z的气体和一种只含X、Z的液体(在常温、常压下)反应,根据元素守恒可知,生成物中应有N、H、O三种元素,该生成一种离子化合物,则其化学式为NH4NO3 或NH4NO2,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;NH4NO3 或NH4NO2;
(4)X、Y、Z和W组成一种化合物,其原子个数之比为5:1:3:1,且该化合物具有还原性,则该物质为NH4HSO3,
①NH4HSO3与过量稀NaOH溶液反应的离子方程式为NH4++HSO3-+2OH-=NH3•H2O+SO32-+H2O,
故答案为:NH4++HSO3-+2OH-=NH3•H2O+SO32-+H2O;
②实验证明NH4HSO3具有还原性可以取少许氯水(或KMnO4、溴水、Fe3+等),滴加NH4HSO3溶液,氯水(或KMnO4、溴水、Fe3+等)褪色,则说明该化合物具有还原性,
故答案为:取少许氯水(或KMnO4、溴水、Fe3+等),滴加NH4HSO3溶液,氯水(或KMnO4、溴水、Fe3+等)褪色,则说明该化合物具有还原性.
点评 本题考查了原子结构和元素性质的关系,根据原子结构、元素周期表结构确定元素,再结合物质结构、性质分析解答,题目难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝与CuSO4溶液反应:3Al+2Cu2+═2Cu+3Al3+ | |
| B. | 向Ba(OH)2溶液中加过量NaHCO3溶液:HCO3-+Ba2++OH-═H2O+BaCO3↓ | |
| C. | 澄清石灰水与盐酸反应:H++OH-═H2O | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═4NH4++AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
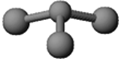
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( ) | A. | ①②③ | B. | ③④⑤ | C. | ②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、NO3-、S2- | B. | NH4+、Fe3+、Cl-、ClO- | ||
| C. | Na+、Al3+、S2-、CH3COO- | D. | K+、Ca2+、Br-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种短周期元素,它们的原子序数依次增大,B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零,D元素的原子最外层电子数为m,次外层电子数为n,E元素的原子L层电子数为m+n,M层电子数为$\frac{m}{2}$-n,请回答下列问题:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大,B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零,D元素的原子最外层电子数为m,次外层电子数为n,E元素的原子L层电子数为m+n,M层电子数为$\frac{m}{2}$-n,请回答下列问题: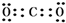 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ﹨ | a | b | c | d |
| a | ﹨ | ↓ | ↑ | - |
| b | ↓ | ﹨ | ↓ | ↓ |
| c | ↑ | ↓ | ﹨ | - |
| d | - | ↓ | - | ﹨ |
| A. | c一定是稀硫酸 | B. | d一定是MgCl2溶液 | ||
| C. | a可能是NaHCO3溶液 | D. | b一定是Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸氢铵和氢氧化钠等物质的量混合 NH4++OH-═NH3↑+H2O | |
| B. | 碳酸氢钙与过量氢氧化钙溶液反应:Ca2++HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 实验室浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++H2O | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com