
过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、鱼池增氧等。过氧化钙在常温下是白色或淡黄色粉末,易溶于酸,难溶于水、乙醇等溶剂。某实验小组在实验室用钙盐制取CaO2·8H2O(该反应为放热反应)。

Ⅰ、第一部分:
(1)仪器B的名称为____________,作用是______________________。
(2)A为实验室制取氨气的装置,写出A中发生反应的化学方程式_______________。
(3)制取CaO2·8H2O一般在0℃~5℃的低温下进行,原因是________________;写出生成CaO2·8H2O的化学方程式________________________________________________。
Ⅱ、第二部分:
欲测定产品中CaO2的含量,实验步骤是:已知:I2 + 2S2O32- = 2I- + S4O62-
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
(4)判断此滴定实验达到终点的方法是: 。
(5)CaO2的质量分数为 (用字母表示);
(6)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“无影响”、“偏低”或“偏高”)。[来源:Z|xx|k.Com]
科目:高中化学 来源: 题型:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期、第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为_______________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为___________________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为____________________,阴极上观察到的现象是____________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为______________________________,这样做的主要缺点是____________________。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(即 ×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
________________________________________________________________________
________________________________________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式为
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
B.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.硫代硫酸钠溶液中滴入稀盐酸:S2O32-+2H+=S↓+SO2↑+H2O
D.在NaHSO4溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质除杂的方法中可行的是
A.除去石英中混有的少量铝粉,可加入氢氧化钠溶液溶解后过滤
B.向含有少量FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液,以除去FeCl2溶液中的FeBr2
C.除去乙酸乙酯中混有的少量乙酸,加入饱和氢氧化钠溶液振荡后分液
D.已知:Ksp(CuS)<Ksp(FeS),可加入过量的难溶电解质FeS,使水中少量的Cu2+转化成硫化物沉淀而除去
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列溶液中不能大量共存的离子组是( )
①NH 、Ag+、PO
、Ag+、PO 、Cl-
、Cl-
②Fe3+、H+、I-、HCO
③Al3+、Mg2+、SO 、CO
、CO
④在pH=12的溶液中,K+、Cl-、HCO 、Na+
、Na+
⑤在pH=0的溶液中,Na+、NO 、SO
、SO 、K+
、K+
A.仅①③④ B.仅①②③
C.全部 D.仅①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的装置分别进行如下实验,各组物质反应后,溶液的导电性比反应前明显增强的是( )
A.向亚硫酸钠溶液中通入氯气:Na2SO3+Cl2+H2O===Na2SO4
+2HCl
B.向硝酸银溶液中通入少量氯化氢:AgNO3+HCl===AgCl↓+HNO3
C.向硫化氢饱和溶液中通入少量氧气:2H2S+O2===2H2O+2S↓
D.向NaOH溶液中通入少量氯气:2NaOH+Cl2===NaCl+NaClO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂方案错误的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A. | CO(g) | CO2(g) | NaOH溶液、 浓H2SO4 | 洗气 |
| B. | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C. | Cl2(g) | HCl(g) | 饱和食盐水、 浓H2SO4 | 洗气 |
| D. | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,该混合物成分的分析方案如图G31所示。
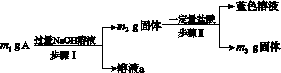
图G31
下列分析不正确的是( )
A.当m1>m2时,溶液a中的阴离子只有1种
B.生成蓝色溶液的离子方程式为Cu+2Fe3+===Cu2++2Fe2+
C.要确定混合物中是否含有Al,可取A加入适量稀盐酸
D.当m2-m3=2.96 g时,Fe3O4的质量至少为2.32 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com