
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料,其制备工艺流程如下图所示:
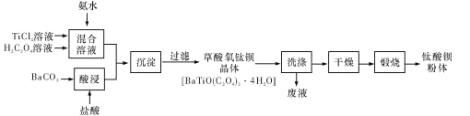
(1)镁的碳化物常见的有MgC2和Mg2C3两种,它们均极易与水发生反应。写出MgC2发生水解反应的化学方程式:_____;Mg2C3的电子式为_____。
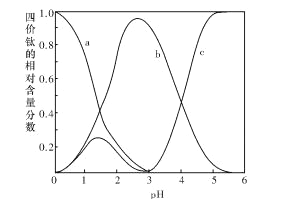
(2)“混合溶液”环节,钛元素在不同pH下主要以种形式存在,如上图所示。实际制备工艺中,先用氨水调节混合溶液的pH于2.5~3之间,再进行“沉淀”,则上图中曲线a对应钛的形式为______填化学符号);写出“沉淀”时的离子方程式:_____。
(3)草酸氧钛钡晶体经蒸馏水数次洗涤后,证明它已被洗涤干净的实验方案为_____。
(4)工业上TiCl4和BaCO3通常用如下方法制备:
①先将金红石(TiO2)与过量焦炭混合,再通入Cl2)并加热到900℃制取TiCl4。请写出该法制备TiCl4的化学方程式:_____。
②BaCO3是将重晶石(主要成分为BaSO4)浸泡在Na2C03溶液中足够长时间来制备。请问Na2CO3溶液的浓度至少要大于_____mol/L才能开始转化。(已知常温下:![]()
![]() ,略CO32-的水解)。
,略CO32-的水解)。
【答案】(1)MgC2+2H2O=Mg(OH)2![]() +C2H2
+C2H2![]() ;(2)
;(2) ![]() (3)TiOC2O4(4) TiO(C2O4)22-+ Ba2++ 4H2O = BaTiO(C2O4)2·4H2O↓(5)取最后一次洗涤液少量于试管中,向其中滴加AgNO3溶液,无白色沉淀生成证明草酸氧钛钡已被洗涤干净(6)TiO2+2C+2Cl2
(3)TiOC2O4(4) TiO(C2O4)22-+ Ba2++ 4H2O = BaTiO(C2O4)2·4H2O↓(5)取最后一次洗涤液少量于试管中,向其中滴加AgNO3溶液,无白色沉淀生成证明草酸氧钛钡已被洗涤干净(6)TiO2+2C+2Cl2![]() TiCl4+2CO(7)2.58×10-4
TiCl4+2CO(7)2.58×10-4
【解析】
(1)MgC2水解生成氢氧化镁和乙炔,反应的方程式为:MgC2+2H2O=Mg(OH)2![]() +C2H2
+C2H2![]() ; Mg2C3属于离子化合物,其电子式为
; Mg2C3属于离子化合物,其电子式为![]() ;
;
故答案为:MgC2+2H2O=Mg(OH)2![]() +C2H2
+C2H2![]() ;
;![]() ;
;
(2)据“沉淀”时生成草酸氧钛钡晶体中含有TiO(C2O4)22-(即b微粒),随着氨水的不断加入C2O42-浓度逐渐增大的趋势可以判断a对应钛的形式为TiOC2O4。根据沉淀的化学式即可写出离子方程式TiO(C2O4)22-+ Ba2++ 4H2O = BaTiO(C2O4)2+4H2O↓。
(3)根反应据过程知洗涤液中可能含有Cl—,所以取最后一次洗涤液少量于试管中,向其中滴加AgNO3溶液,如无白色沉淀生成,证明草酸氧钛钡已被洗涤干净。答案: 取最后一次洗涤液少量于试管中,向其中滴加AgNO3溶液,如无白色沉淀生成,证明草酸氧钛钡已被洗涤干净 。
(4)①由足量焦炭和Cl2反应判断产物为TiCl4和CO,所以化学方程式为TiO2+2C+2Cl2![]() TiCl4+2CO。答案:TiO2+2C+2Cl2
TiCl4+2CO。答案:TiO2+2C+2Cl2![]() TiCl4+2CO 。
TiCl4+2CO 。
②设BaSO4饱和溶液中c(Ba2+)和c(SO42-)均为xmol·L-1,由KSP(BaSO4)=c(Ba2+)c(SO42-)知:x2=1.0×10-10(mol·L-1)2,可求出c(Ba2+)=1.0×10-5mol·L-1。重晶石转化为碳酸钡,需满足Q(BaCO3)=c(Ba2+)c(CO32-)=1.0×10-5mol·L-1×c(CO32-)>KSP(BaCO3),则c(CO32-)>2.58×10-9(mol·L-1)2÷1.0×10-5mol·L-1=2.58×10-4mol·L-1,所以Na2CO3 溶液的浓度至少要大于2.58×10-4mol/L 才能开始转化。答案:2.58×10-4。


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C均为食品中常见的有机化合物,F是生活中常见的气体燃料,也是含氢百分含量最高的有机物,D和E有相同的元素组成。它们之间的转化关系如图:

请回答:
(1)有机物A中官能团的名称是________
(2)反应①的化学方程式___________
(3)F与氯气反应生成亿元取代物待测化学方程式___________
(4)下列说法正确的是____________
A.3个反应中的NaOH都起催化作用
B.反应⑤属于加成反应
C.A的同分异构体不能与金属钠反应生成氢气
D.1molB、1molC完全反应消耗NaOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 有能量变化的过程均为化学变化
B. 原电池是将电能转变为化学能的装置
C. 反应物的总能量高于生成物的总能量时发生放热反应
D. 旧化学键断裂所放出的能量低于新化学键形成所吸收的能量时发生吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型锂电池装置,电池充、放电反应为![]()
![]()
![]() 。放电时,需先引发铁和氯酸钾反 应使共晶盐熔化。下列说法不正确的是
。放电时,需先引发铁和氯酸钾反 应使共晶盐熔化。下列说法不正确的是
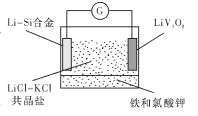
A. 共晶盐储热效果好,利于电解质熔化
B. 整个过程的能量转化只涉及化学能转化为电能
C. 放电时LiV3O8电极的反应为xLi++xe-+LiV3O8= Li1+XV3O8
D. 充电时 Cl-移向LiV3O8电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:2CH3OH(l) + 3O2(g) → 2CO2 (g) + 4H2O(l),其工作原理示意图如图,下列说法正确的是( )
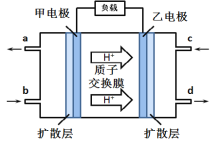
A. 甲为电池的负极,发生还原反应
B. 负极的电极反应式为:CH3OH +H2O-6e-=CO2+6H+
C. b口通入的气体为O2
D. 用该电池进行电解水,当电路中转移0.2NA个电子时,生成2.24L氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物在化工、医药、材料等领域有着广泛的应用,回答下列问题:
(1)参照下图 B、F 元素的位置,依据第二周期元素第一电离能的变化规律,用小黑点标出 C、N、O 三 种元素的相对位置。
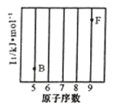
(2)碳的一种单质的结构如图(a)所示,则碳原子的杂化轨道类型为_________________ 。
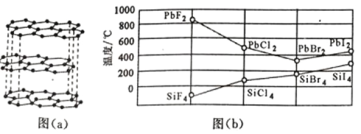
(3)二卤化铅 PbX2 的熔点如图(b)所示,可推断:依 F、Cl、Br、I 次序,PbX2 中的化学键 的离子性_____( 填“增 强”、“ 不变”或“减弱”, 下 同 ), 共价性_____。
(4)NH3 和 F2 在 Cu 催化下可发生反应 4NH3+3F2 ![]() NF3+3NH4F,化学方程式中的 5 种物质所属的晶体 类型有_____(填序号)。写出基态铜原子的价电子排布式_____。
NF3+3NH4F,化学方程式中的 5 种物质所属的晶体 类型有_____(填序号)。写出基态铜原子的价电子排布式_____。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
(5)BF3 与一定量水形成(H2O)2·BF3 晶体 Q,Q 在一定条件下可转化为 R: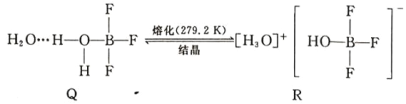 晶体 R 中含有的化学键包 括_____。
晶体 R 中含有的化学键包 括_____。
(6)水杨酸第一级电离形成离子![]() ,相同温度下,水杨酸的 Ka2____________________________苯酚
,相同温度下,水杨酸的 Ka2____________________________苯酚
(![]() )的 Ka(填“>”“ =”或“<”),其原因是______________。
)的 Ka(填“>”“ =”或“<”),其原因是______________。
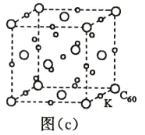
(7)碳的另一种单质 C60 可以与钾形成低温超导化合物,晶体结构如图(c)所示,K 位于立方体的棱上和 立方体的内部,此化合物的化学式为____________;其晶胞参数为 1.4 nm,阿伏加德罗常数用 NA 表 示,则晶体的密度为________________g·cm-3。(只需列出式子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用硫酸厂废渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式可表示为[Fe2(OH)n(SO4)3-0.5n]m,主要工艺流程下:
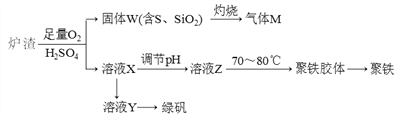
下列说法不正确的是
A. 炉渣中FeS与稀硫酸和氧气反应的离子方程式为:4FeS+3O2+12H+===4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入H2O2溶液得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸干即得绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
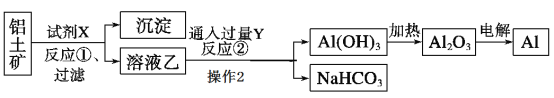
(1)试剂X应选择________(选填“氢氧化钠溶液”、“盐酸”),反应①过滤后所得沉淀为__ ;反应①的离子方程式_____;
(2)反应②中Y是_____(写化学式);
(3)写出由Al(OH)3加热为Al2O3的反应方程式_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com