
| A. | 葡萄糖变为葡萄糖酸 | B. | 植物油变成硬化油 | ||
| C. | 蛋白质变为氨基酸 | D. | 油脂变质(酸败) |
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:解答题
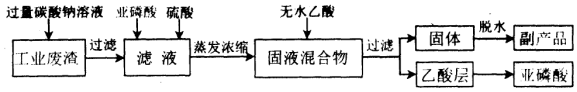
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵态氮肥和草木灰适宜混合使用 | |
| B. | 75%的酒精溶液可用作皮肤消毒剂 | |
| C. | SO2可用于漂白银耳 | |
| D. | 油脂和纤维素均可为人体提供能量. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可用于杀菌、消毒 | |
| B. | 煤经过气化和液化等物理变化可转化为清洁能源 | |
| C. | 氯气和明矾均可做自来水的消毒剂 | |
| D. | 食品保鲜剂中所含铁粉和生石灰均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(S) (g) | 褪色时间(S) | ||
| C(mol•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
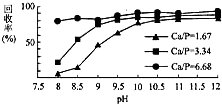 三氯氧磷(POCl3)常温下为无色液体,有广泛应用,近年来,三氯氧磷的工业生产由三氧化磷的“氯气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用,近年来,三氯氧磷的工业生产由三氧化磷的“氯气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
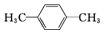 (4)间甲基苯甲醛 (5)CH2=CHCH2CH3(6)
(4)间甲基苯甲醛 (5)CH2=CHCH2CH3(6)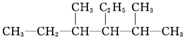
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2C=CH-CH=CH2 1,3-二丁烯 | B. |  :间二甲苯 :间二甲苯 | ||
| C. | 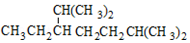 2,6-二甲基-5-乙基庚烷 2,6-二甲基-5-乙基庚烷 | D. | 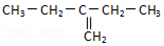 2-乙基-1-丁烯 2-乙基-1-丁烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com