
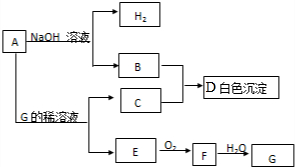
分析 金属A与氢氧化钠溶液反应生成B与氢气,则A为Al,B为NaAlO2.Al与G的稀溶液反应得到气体E,E与氧气反应得到气体F,F与水反应得到G,N元素化合物符合转化关系,可推知G为HNO3、E为NO、F为NO2,故C为Al(NO3)3,铝盐与偏铝酸盐发生水解反应反应得到D为Al(OH)3,据此解答.
解答 解:金属A与氢氧化钠溶液反应生成B与氢气,则A为Al,B为NaAlO2.Al与G的稀溶液反应得到气体E,E与氧气反应得到气体F,F与水反应得到G,N元素化合物符合转化关系,可推知G为HNO3、E为NO、F为NO2,故C为Al(NO3)3,铝盐与偏铝酸盐发生水解反应反应得到D为Al(OH)3.
(1)由上述分析可知,A为Al,D为Al(OH)3,G为HNO3,
故答案为:Al;Al(OH)3;HNO3;
(2)B和C反应生成D的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)Al在碱性溶液中与NO3- 反应时生成NaAlO2和NH3,反应的离子方程式为:8Al+3NO3-+5OH-+2H2O=8AlO2-+NH3↑,
故答案为:8Al+3NO3-+5OH-+2H2O=8AlO2-+NH3↑;
(4)相同条件下,向500ml NO和NO2的混合气体中通入187.5mLO2,所有气体恰好完全被水吸收生成HNO3,发生反应:4NO+3O2+2H2O=4HNO3,4NO2+O2+2H2O=4HNO3,令NO和NO2的体积分别为xmL、ymL,则:
4NO+3O2+2H2O=4HNO3
xmL $\frac{3}{4}$xmL
4NO2+O2+2H2O=4HNO3
ymL $\frac{y}{4}$mL
所以$\left\{\begin{array}{l}{x+y=500}\\{\frac{3}{4}x+\frac{y}{4}=187.5}\end{array}\right.$
解得x=125 y=375
故NO和NO2的体积之比为125mL:375mL=1:3,
故答案为:1:3;
(5)等体积的NO和NO2通入NaOH溶液中可生成盐和水,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,室温下0.1mol•L-1的上述盐溶液pH=8.3.原因是:NO2-水解显碱性,
故答案为:NO+NO2+2NaOH=2NaNO2+H2O;NO2-水解显碱性;
(6)亚硝酸钠溶液中,NO2-水解显碱性,该溶液中所有离子的浓度由大到小的顺序为:c(Na+)>c(NO2-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(NO2-)>c(OH-)>c(H+).
点评 本题考查无机物的推断,A与氢氧化钠溶液反应生成氢气为推断突破口,再结合A+G→E、E$\stackrel{氧气}{→}$F$\stackrel{水}{→}$G进行推断,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温下NaF溶液的pH大于7 | |
| B. | HF能与Na2CO3溶液反应,产生CO2气体 | |
| C. | 1mol/L的HF水溶液能使紫色石蕊试液变红 | |
| D. | 用HF溶液做导电性实验,灯泡很暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b-m-n | B. | b+m-n | C. | b-m+n | D. | b+m+n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然油脂含酯基属于酯类物质 | B. | 石油裂化和裂解都可制得烯烃 | ||
| C. | 酚醛树脂是酚与醛的缩聚产物 | D. | 麦芽糖和蔗糖的水解产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 充电时电源的正极应与电池的X极相连 | |
| B. | 放电时负极电极反应式为:XH6+6e-═X+6H+ | |
| C. | 充电时阳极电极反应式为:6Ni(OH)2+6OH-═6NiOOH+6H2O+6e- | |
| D. | 该电池放电反应1 mol XH6时,若用于电解水,理论上可得到16g氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 晶体 | NaCl | MgCl2 | AlCl3 | SiCl4 | 单质R |
| 熔点 | 810℃ | 710℃ | 180℃ | -70℃ | 2300℃ |
| 沸点 | 1465℃ | 1418℃ | 177.8℃ | 57℃ | 2500℃ |
| A. | SiCl4是分子晶体 | |
| B. | MgCl2中键的强度比NaCl中键的强度小 | |
| C. | 单质R可能是原子晶体 | |
| D. | AlCl3为离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
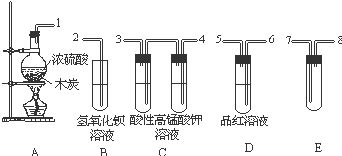 浓H2SO4与炭反应,产物成分可用如图装置来确认:
浓H2SO4与炭反应,产物成分可用如图装置来确认:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | HBr的电子式为H+(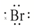 )- )- | |
| C. | 3.4g氨气中含有0.6NA个N-H键 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com