
| A. | Na3PO4 | B. | Na4P2O7 | ||
| C. | Na4P2O7 和Na5P3O10 | D. | Na3PO4、Na4P2O7和Na5P3O10 |
分析 将48gNaOH的物质的量为1.2mol,58.8g固态纯H3PO4的物质的量为0.6mol,得到79.8g固体A和27g水,说明钠与磷全部转化到A中,所以N(Na):N(P)=2:1,由此分析解答.
解答 解:将48gNaOH的物质的量为1.2mol,58.8g固态纯H3PO4的物质的量为0.6mol,得到79.8g固体A和27g水,说明钠与磷全部转化到A中,所以N(Na):N(P)=2:1,
A、N(Na):N(P)=3:1,故A错误;
B、N(Na):N(P)=2:1,可能,故B正确;
C、Na4P2O7 中N(Na):N(P)=2:1,Na5P3O10,N(Na):N(P)=5:3<2:1,所以混合体系中N(Na):N(P)<2:1,所以不可能,故C错误;
D、Na4P2O7 中N(Na):N(P)=2:1,Na5P3O10,N(Na):N(P)=5:3<2:1,Na3PO4,N(Na):N(P)=3:1>2:1,所以混合体系中N(Na):N(P)可能为2:1,故D正确;
故选BD.
点评 本题考查学生用原子个数之比解题,学生首先根据物质的转化,得到钠与磷全部转化到A中,求出两种元素的原子个数之比,注意CD选项平均值的运用,有一定的难度.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:解答题
 一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向盐酸酸化的Ba(NO3)2溶液中通入SO2 | 有白色沉淀生成 | BaSO3难溶于酸 |
| B | 向等浓度的KCl、Kl混合液中滴加AgNO3溶液 | 先出现白色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 溴乙烷与NaOH水溶液共热后,加HNO3酸化,滴加AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷含溴元素 |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R原子的电子数为10+n | B. | R能形成Rn-离子 | ||
| C. | R的最高氧化物为R2On或ROn/2 | D. | R的气态氢化物的化学式是H8-nR |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
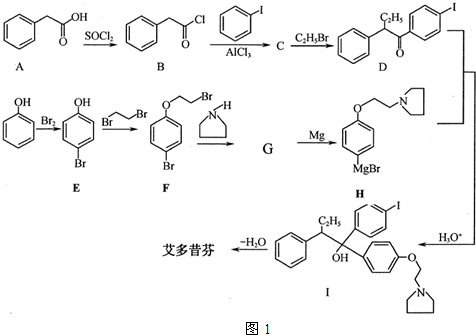
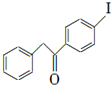 ; 艾多昔芬
; 艾多昔芬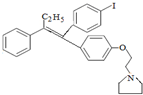 .
.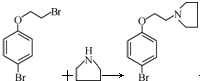 +HBr
+HBr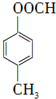 .
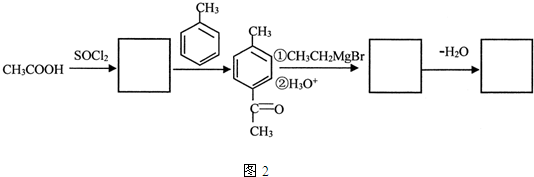
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:H2O>H2Se>H2S | B. | 酸性:H2SO4>H2CO3>HClO | ||
| C. | 硬度:I2>Br2>Cl2 | D. | 碱性:KOH>NaOH>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
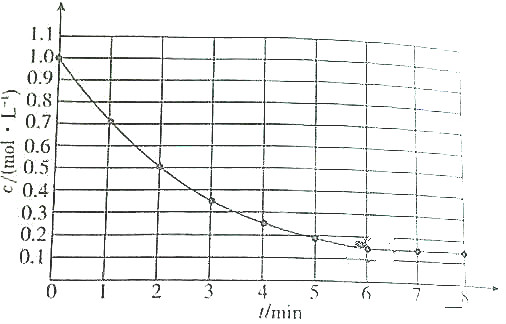
| A. | 第6min后,生成A的平均速率为0mol/(L•min) | |
| B. | A的平衡转化率为85% | |
| C. | 升高温度时,生成A的平均速率大于消耗A的平均速率 | |
| D. | 降低温度时,生成A的平均速率和消耗A的平均速率以不同倍数减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com