
(14分)能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。

请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;该反应属于 (填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大
(3)从反应开始到建立平衡, v(H2)=
;该温度下CO(g)+2H2(g)
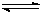 CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1>P2)。
(5)科学家常用 (填仪器名称)来直接测定某一反应的反应热,现测得:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol,又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
(1)b(1分) 放热(1分) (2)AB(2分)
(3)0.15mol·L-1·min-1(2分) 12(2分) 减小(1分)
(4)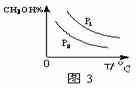 (2分)
(2分)
(5) 量热计(1分) CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-280.9kJ/mol(2分)
【解析】(1)催化剂能降低活化能,从而加快反应速率,所以b曲线不是使用了催化剂。根据图像可知,反应物的总能量大于生成物的总能量,所以是放热反应。
(2)根据图像可知,CO的浓度减少,甲醇的浓度增加,所以起始时CO时1.0mol/L×2=2.0mol,A不正确。增加CO的浓度,平衡显正反应方向移动,可以提高氢气的转化率,但会降低CO的转化率,B不正确。反应前后体积是减小的,所以压强也是减小的,C正确。D中相当于增大压强,平衡向正反应方向移动,n(CH3OH)/n(CO)会增大,D正确,答案选AB。
(3)平衡时生成甲醇0.75mol/L,所以消耗氢气是0.75mol/L×2=1.5mol/L,则氢气的反应速率是1.5mol/L÷10min=0.15mol·L-1·min-1。平衡时氢气的浓度是2.0mol/L-1.5mol/L=0.5mol/L,素平衡常数为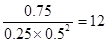 。升高温度,平衡向逆反应方向移动,平衡常数减小。
。升高温度,平衡向逆反应方向移动,平衡常数减小。
(4)正反应是体积减小的、放热的可逆反应。所以温度越高甲醇的含量越低。但压强越大,甲醇的含量越高,图像为(见答案)。
(5)直接测定反应热的是量热计。根据盖斯定律可知①-②×2即得到CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l),所以反应热是-192.9kJ/mol-44 kJ/mol×2=-280.9kJ/mol。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com