
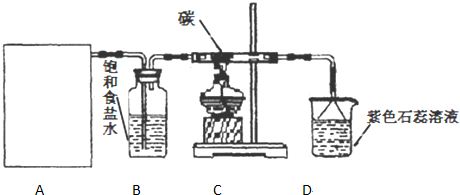
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰和氯气、水;
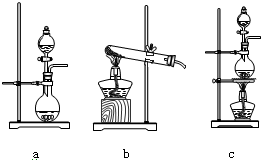
(2)依据反应物状态和反应条件选择发生装置;
(3)依据生成物二氧化碳与氯化氢所含元素,结合原子个数守恒规律判断从B装置导出的气体成分;
(4)氯气、氯化氢有毒,直接排放容易造成空气污染;氯化氢溶于水得到盐酸,溶液显酸性;
(5)4瓶氯气的质量为0.122L×2.91g/L×4=1.42g,根据方程式MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O计算二氧化锰的质量;
(6)①氯化亚铁与氯气反应生成氯化铁;三价铁离子遇到硫氰酸钾显血红色;
②生活中常用的漂白、消毒的物质为84消毒液,有效成分为次氯酸钠.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰和氯气、水,方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)固体二氧化锰与液体浓盐酸在加热条件下反应生成氯化锰和氯气、水,应选择固体与液体加热反应装置,
故选:c;
(3)从C装置出来的气体中含有CO2和HCl,则B装置中应含有碳、氢、氯元素,依据原子个数守恒可知从B装置导出的气体成分为:H2O、Cl2;
(4)氯气、氯化氢有毒,直接排放容易造成空气污染,用d装置进行尾气处理,吸收氯气、氯化氢,防止污染空气;氯化氢溶于水得到盐酸,溶液显酸性,遇到石蕊显红色;
故答案为:吸收氯气、氯化氢,防止污染空气;紫色石蕊试液变红;
(5)4瓶氯气的质量为0.122L×2.91g/L×4=1.42g,
设需要二氧化锰的质量为x,则:
MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
87g 71g
m 1.42g
解得m=1.74g;
实际称量的MnO2固体的质量必须适当多余理论量,因为在收集过程中可能部分氯气损耗;
故答案为:1.74g;收集氯气时有损失;
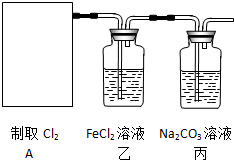
(6)①氯化亚铁与氯气反应生成氯化铁,离子方程式:2Fe2++Cl2=Fe3++2Cl-,三价铁离子遇到硫氰酸钾显血红色,要证明FeCl2与Cl2发生了氧化还原反应,实验方法为:取少量反应后的溶液置于洁净的试管中,向其中滴加硫氰酸钾溶液,若产生红色溶液,证明生成了三价铁离子,则氯化亚铁与氯气发生氧化还原反应;
故答案为:2Fe2++Cl2=Fe3++2Cl-;取少量反应后的溶液置于洁净的试管中,向其中滴加硫氰酸钾溶液,若产生红色溶液,证明生成了三价铁离子,则氯化亚铁与氯气发生氧化还原反应;
②氯气通入到碳酸钠溶液,反应生成氯化钠、次氯酸钠和碳酸氢钠,次氯酸钠为生活中常用的漂白、消毒的物质;
故选:B.
点评 本题考查了氯气的制备和性质的检验,明确氯气制备原理和氯气的化学性质是解题关键,题目难度中等.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
 .
.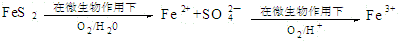
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
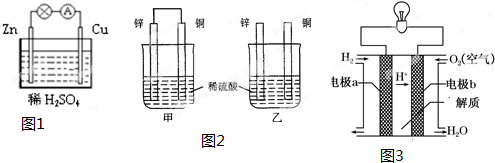
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍(Be)的氧化物的水化物可能具有两性 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L CCl4含有的分子数为NA | |
| B. | 常温常压下,17g NH3所含的原子数目为4NA | |
| C. | 铝与足量盐酸反应,生成2.24L H2时,转移的电子数为0.2NA | |
| D. | 0.1mol/L Na2CO3溶液中含有的Na+数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+NH3•H2O+2BaSO4↓ | |
| B. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL | B. | 72mL | C. | 78mL | D. | 100mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com