
| 2.24L |
| 22.4L/mol |
| 10.2g |
| 102g/mol |
| 2.24L |
| 22.4L/mol |
| 10.2g |
| 102g/mol |
| (0.2×1+0.1×2)mol |
| 0.1L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
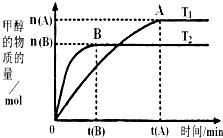 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇:(CO2+3H2═CH3OH+H2O),并开发出直接以甲醇为燃料的燃料电池.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇:(CO2+3H2═CH3OH+H2O),并开发出直接以甲醇为燃料的燃料电池.| nA |
| tA |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表的一部分,表中所列字母分别代表一种元素.
下表是元素周期表的一部分,表中所列字母分别代表一种元素.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | A | ||||||
| 二 | B | C | D | E | |||
| 三 | F | G | H | I | K | ||
| 四 | J | L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纸层析法进行Cu2+和Fe3+混合液分离时,Fe3+在固定相中分配比例较低 |
| B、用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量 |
| C、在铝与过量3mol?L-1硫酸溶液反应的试管中加入少量NaCl固体,反应速率会加快 |
| D、吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+ Al3+ Cl- HCO3-NO3- |
| B、H+ Ca2+ PO43- Cl- |
| C、NH4+Ag+ OH-Cl- |
| D、Mg2+ SO42- H+NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中放出的气体的体积为4.48L |
| B、稀释、定容操作中用到的全部玻璃仪器有:烧杯、胶头滴管及500mL容量瓶 |
| C、所得溶液中Na+和AlO2-的个数之比一定为1:1 |
| D、整个反应过程中只有水做氧化剂而且共转移电子0.4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com