
| A. | 氯化钠Na${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$ | |
| B. | 氮气 | |
| C. | 氯化氢H${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$ | |
| D. | 二氧化碳${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$C${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
分析 A.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
B.氮气分子中存在氮氮三键,应该存在3对共用电子对;
C.氯化氢分子中存在一对共用电子对;
D.二氧化碳中C与O分别形成两对共价键.
解答 解:A.氯化钠属于离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,氯化钠正确的电子式为 ,故A错误;
,故A错误;
B.氮气分子中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气正确的电子式为 ,故B错误;
,故B错误;
C.氯化氢属于共价化合物,分子中存在一个H-Cl键,氯原子最外层达到8个电子,氯化氢正确的电子式为 ,故C正确;
,故C正确;
D.二氧化碳为共价化合物,C与O形成两对共价键,其电子式为 ,故D错误;故选C.
,故D错误;故选C.
点评 本题考查了电子式的判断,该题是高考中的常见题型与重要的考点,该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法.


科目:高中化学 来源: 题型:选择题
| A. | 54 | B. | 77 | C. | 131 | D. | 185 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 | |
| C. | pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)相等 | |
| D. | 在NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
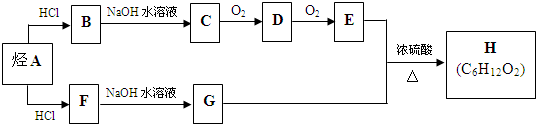
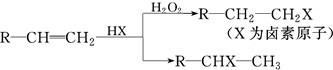
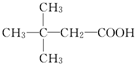 .(用结构简式表示)
.(用结构简式表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的结构示意图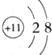 | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 纯碱的化学式为Na2CO3 | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室常用如图所示的装置制取少量的乙酸乙酯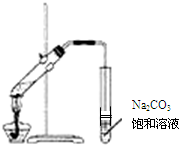 | |
| B. | 制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 | |
| C. | 用玻璃棒搅拌漏斗中的液体以加快过滤的速度 | |
| D. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的上端倒出 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:填空题
空气中CO2的含量及有效利用,已经引起各国的普遍重视
Ⅰ:目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) 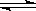 CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
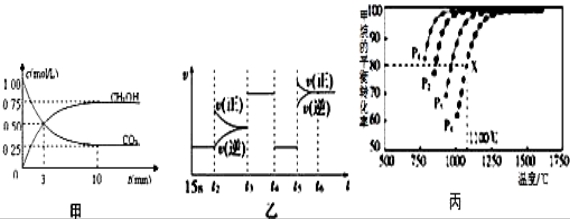
(1)前3min内,平均反应速率v(H2)=_________ _____.此温度下该反应的平衡常数为____________(保留两位小数).
(2)下列措施中,既能使反应加快,又能使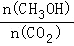 增大的是___________.
增大的是___________.
A.升高温度 B.充入惰性气体 C.将H2O(g)从体系中分离 D.再充入1mol H2
(3)图乙中t5时引起平衡移动的 条件是_____________.(填序号)
条件是_____________.(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.增大体系压强
(4)反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,化学平衡____________(填“正向”、“逆向”或“不”)移动.
Ⅱ:利用CO2(g)+CH4(g) 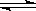 2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
(5)下列事实能说明该反应达到平衡的是_______________
a.CO的物质的量不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO2)=2v逆(H2)
d.混合气体压强不再发生变化
e.单位时间内生成n mol CH4的同时消耗2n mol H2
(6)据图可知P1、P2、P3、P4由小到大的顺序是__________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com