
| A | B | C | D | |
| 碱性 | AOH>BOH | AOH<BOH | AOH>BOH | AOH<BOH |
| 酸性 | HC>HD | HC>HD | HC<HD | HC<HD |
| A. | A | B. | B | C. | C | D. | D |
分析 AC、BD的pH=7,则可能为强酸强碱盐或弱酸弱碱盐,AD溶液的pH>7,则为强碱弱酸盐,BC溶液的pH<7,则为强酸弱碱盐,由此可知,AC为强酸强碱盐,而BD为弱酸弱碱盐,以此来解答.
解答 解:AC、BD的pH=7,则可能为强酸强碱盐或弱酸弱碱盐,AD溶液的pH>7,则为强碱弱酸盐,则AOH为强碱,BC溶液的pH<7,则为强酸弱碱盐,HC为强酸,由此可知,AC为强酸强碱盐,而BD为弱酸弱碱盐,即B为弱碱,D为弱酸酸,所以碱性为AOH>BOH,酸性为HC>HD,
故选A.
点评 本题考查盐类水解规律的应用,明确盐中有弱才水解的规律是解答本题的关键,注意BD可能为醋酸铵,题目难度中等


科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、纤维、油脂、淀粉、聚乙烯都是高分子化合物 | |
| B. | 蛋白质的水解产物为氨基酸 | |
| C. | 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 | |
| D. | 石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同类型的离子晶体,晶格能越大,形成的晶体越稳定 | |
| B. | NH3和H3O+是等电子体,因此结构都是三角锥形 | |
| C. | 邻羟基苯甲醛沸点低于对羟基苯甲醛,原因是前者存在分子内氢键后者存在分子间氢键 | |
| D. | H3O+、HF2-和[Ag(NH3)2]+中均存在配位键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图.
pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图. H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.
H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
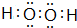 .F的原子结构示意图为:
.F的原子结构示意图为: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO是一种红棕色气体,易溶于水 | |
| B. | 汽车尾气中NO的来源是空气中的N2与O2在汽车气缸内的高温环境下的反应产物 | |
| C. | 工业生产硝酸的原料主要有NO和空气 | |
| D. | 由于NO在血管中的特殊作用,所以NO无毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
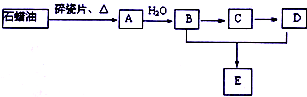 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有浓郁香味、不溶于水的烃的衍生物.A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略).
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有浓郁香味、不溶于水的烃的衍生物.A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略). ;
; ,90g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L.
,90g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大S02的浓度 | B. | 提高O2与SO2的体积比 | ||
| C. | 减小压强 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com