
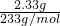 =0.01mol,根据SO42-+Ba2+=BaSO4↓,SO42-的物质的量也为0.01mol,亚硫酸钡的物质的量为
=0.01mol,根据SO42-+Ba2+=BaSO4↓,SO42-的物质的量也为0.01mol,亚硫酸钡的物质的量为 =0.01mol,根据反应SO32-+Ba2+=BaSO3↓,可得SO32-的物质的量也为0.01mol;
=0.01mol,根据反应SO32-+Ba2+=BaSO3↓,可得SO32-的物质的量也为0.01mol; =0.025mol,根据NH4++OH-
=0.025mol,根据NH4++OH- NH3+H2O,NH4+的物质的量是0.025mol,
NH3+H2O,NH4+的物质的量是0.025mol, =0.1mol/L,NH4+的物质的量浓度为c(NH4+)=
=0.1mol/L,NH4+的物质的量浓度为c(NH4+)=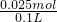 0.25 mol/L,故答案为:0.1mol/L;0.25 mol/L;
0.25 mol/L,故答案为:0.1mol/L;0.25 mol/L;

 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+ | B、一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+ | C、c (Clˉ) 为 4.00 mol?L-1,c (Al3+) 为1.00 mol?L-1 | D、c (Mg2+) 为 1.00 mol?L-1,c(Na+) 为 1.50 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高二1月学业水平模拟测试(四)化学试卷(解析版) 题型:选择题
某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Clˉ。为确认该溶液组成进行如下实验:①取20.0 mL该溶液,加入25.0 mL 4.00 mol·L-1NaOH溶液,有白色沉淀、无剌激气味气体。过滤、洗涤、干燥,得沉淀1.16 g。再将滤液稀释至100 mL,测得滤液中c(OHˉ)为0.20 mol·L-1;②另取20.0 mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48 g。由此可得出关于原溶液组成的正确结论是
A.一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+
B.一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+
C.c (Clˉ) 为 4.00 mol·L-1,c (Al3+) 为1.00 mol·L-1
D.c (Mg2+) 为 1.00 mol·L-1,c(Na+ ) 为 0.50 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com