
| A. | c(H+)=10-4 mol•L-1的溶液中:NH4+、K+,SO42-,NO3- | |
| B. | 无色溶液中:Na+,Cu2+,Cl-,NO3- | |
| C. | 0.1mol•L-1 AgNO3溶液中:H+,K+,SO42-,I- | |
| D. | 饱和氯水中:Cl-,Na+,NO3-,SO32- |
分析 A.四种离子之间不发生反应,都不与氢离子反应;
B.铜离子为有色离子,不能大量存在;
C.硫酸根离子、碘离子与银离子反应;
D.氯水具有强氧化性,能够氧化亚硫酸根离子.
解答 解:A.NH4+、K+,SO42-,NO3-之间不反应,都不与H+反应,在溶液中能够大量共存,故A正确;
B.Cu2+为有色离子,不满足溶液无色的条件,故B错误;
C.AgNO3溶液与SO42-、I-发生反应,在溶液中不能大量共存,故C错误;
D.饱和氯水具有强氧化性,能够氧化SO32-,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.


科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al、Fe、Cu都能导电,它们的氧化物都能与酸反应 | |
| B. | 铝热反应是指铝能将所有的金属从其氧化物中置换出来 | |
| C. | CO2、NO、SO2都是非金属氧化物,都属于酸性氧化物 | |
| D. | CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的H2O与CH2D2含有的质子数相同 | |
| B. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液中H+数目大于0.1NA | |
| C. | 常温下1 L 0.5mol•L-1NH4Cl溶液与2L 0.25mol•L-1NH4Cl溶液所含NH4+的数目相同 | |
| D. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的N2和CO所含分子数均为NA | |
| B. | 在标准状况下,22.4L CH4与18g H2O所含的电子数均为10NA | |
| C. | 一定温度下,1L 1mol•L-1的CH3COONa溶液含NA个CH3COO- | |
| D. | 1mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
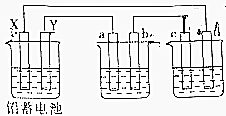 用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )
用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )| A. | 电路中通过1mol电子时,Y电极质量增加48g | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO${\;}_{4}^{2-}$(aq)+2e-=PbSO4(s)+2H2O(l) | |
| C. | c、d电极产生气体的物质的量之比为1:2 | |
| D. | X极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
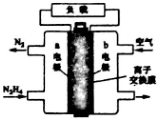 液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )| A. | 放电时,b极附近溶液pH减小 | |
| B. | a极的反应式为N2H4+4OH--4e-═N2↑+4H2O | |
| C. | 放电时,电子从b极经过负载流向a极 | |
| D. | OH-通过阴离子交换膜向a极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
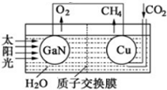 氮化镓是目前最热门的半导体材料,应用前景非常广阔.已有科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4,装置如图所示,回答下列问题:
氮化镓是目前最热门的半导体材料,应用前景非常广阔.已有科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4,装置如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
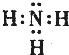 ,稳定性最强的氢化物的结构式为H-O-H;
,稳定性最强的氢化物的结构式为H-O-H; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com