
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计).其中能表示等质量的氢气与氦气的是( )
A.
B.
C.
D.
【答案】A
【解析】解:设氢气与氦气都为mg,则二者的物质的量之比为 ![]() :
: ![]() =2:1,则体积之比为2:1; A、白球代表氢原子,黑球代表氦原子,符合物质的量之比为2:1,体积之比为2:1,故A正确;
=2:1,则体积之比为2:1; A、白球代表氢原子,黑球代表氦原子,符合物质的量之比为2:1,体积之比为2:1,故A正确;
B、白球代表氢原子,黑球代表氦原子,物质的量之比为2:1,体积之比为2:1,但氦气是单原子构成的分子,故B错误;
C、白球代表氢原子,黑球代表氦原子,物质的量之比为2:1,但体积之比为1:2,故C错误;
D、白球代表氢原子,黑球代表氦原子,物质的量之比为1:1,体积之比为2:1,故D错误;
故选A.
白球代表氢原子,黑球代表氦原子,等质量的氢气与氦气,其物质的量之比为2:1,体积之比为2:1.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】食品保鲜膜的材质有聚乙烯、聚氯乙烯等种类。下列叙述错误的是
A.等质量的聚乙烯和乙烯完全燃烧消耗氧气的量相等
B.聚氯乙烯薄膜放入试管中加强热可产生酸性气体,故不宜装熟食
C.聚氯乙烯的单体可由聚乙烯的单体与氯化氢加成制得
D.废弃的聚乙烯和聚氯乙烯均可回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列说法正确的是( )
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n
②已知BaSO4的Ksp=c(Ba2+)·c(SO42-),所以在BaSO4溶液中有![]()
③物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-) =2c(H+) + c(CH3COOH)
④在0.1 mol/l氨水中滴加0.1 mol/l盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1
A. ①④ B. ②③ C. ③④ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学完元素周期理论之后,某同学欲探究硫、碳、硅元素非金属性的相对强弱,设计如下实验: 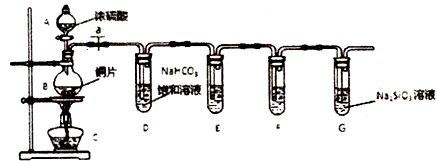
回答下列问题:
(1)填写所示仪器名称:A、B .
(2)实验步骤:连接仪器、、加药品后,打开a,然后滴入浓硫酸,加热.烧瓶中反应的化学方程式为 .
(3)问题探究:
①试管D中发生反应的离子方程式是 .
②甲同学发现装置E中所盛品红溶液颜色无明显变化,F中所盛澄清石灰水变浑浊,据此认定硫元素的非金属性强于碳,而乙同学不同意甲的观点,其理由是 .
③装置G中出现的实验现象为 , 即可证明碳元素的非金属性强于硅元素.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 化学反应除了生成新物质外,还伴随着能量的变化
B. 放热反应一定不需要加热即可发生
C. 需要加热才能发生的化学反应一定是吸热反应
D. 化学反应中的能量变化都表现为热量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图:

请回答下列问题:
(1)图中甲池是__________(填“原电池”、“原解池”、“原镀池”),乙池中A电极的名称是__________(填“正极”、“负极”、“阴极”或“阳极”)
(2)写出甲池中甲醇发生反应的电极反应式:______________________________________________
(3)当乙池中B极质量增加10.8克,理论上甲池中消耗O2的体积为:_______L(标准状况),此时丙池中D极析出3.2g某金属,则丙池中的某盐溶液可能是__________(填字母,下同)
a.MgSO4溶液b.CuSO4溶液c.NaCl溶液d.AgNO3溶液
(4)若丙中电极不变,将其溶液换成NaCl溶液,一段时间后,丙中溶液的pH将_________(填“增大”、“减小”或“不变”);甲中溶液的pH将_________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列有关仪器的使用,能实现的是_______________(填序号)
A.用托盘天平称取11.70g食盐
B.用量筒量取12.36mL盐酸
C.用酸式滴定管量取21.20mL 0.10mol/L H2SO4溶液
D.用200mL容量瓶配制500mL 0.1mol/L NaCl溶液
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
(2)下图是酸式滴定管中液面在滴定前后的读数:则C (NaOH) = ______________。

(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏______。
III. 我们知道空气中含有N2、O2、CO2、H2S等气体。试判断下列滴定操作的终点、分析下列现象的原因,并写出有关离子方程式。
(1)以酚酞为指示剂,用碱液滴定酸液到___________________________为终点。约半分钟后导致褪色的原因:________________________________________________。
(2)以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32-+I2=S4O62-+2I-)到 __________________为终点,约5min后溶液又显色的原因: _________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下: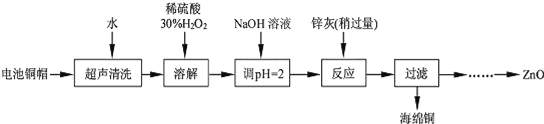
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2 反应的离子反应方程式______________________;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I﹣═2CuI(白色)↓+I2 2S2O32﹣+I2═2I﹣+S4O62﹣
①滴定选用的指示剂为______________,滴定终点观察到的现象为_______________________________;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为__,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会__(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2]=2.0×10﹣20,计算沉淀生成后溶液中c(Cu2+)=__mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2﹣。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0molL﹣1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0molL﹣1HNO3、1.0molL﹣1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
②加入适量的1.0molL﹣1NaOH调节pH,产生沉淀;③过滤;
④______________;⑤过滤、洗涤、干燥;⑥900℃煅烧。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com