
 X、Y、Z、R、W、E为前四周期元素且原子序数依次增大.X的单质与Y的单质在放电条件下反应产生大气污染物,R基态原子的M能层上有3对成对电子,W核外有5个未成对电子.Y、Z分别形成氢化物Q和J,已知Q与J摩尔质量相等,Q的水溶液中加入少量WY2,立即产生大量气泡.E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
X、Y、Z、R、W、E为前四周期元素且原子序数依次增大.X的单质与Y的单质在放电条件下反应产生大气污染物,R基态原子的M能层上有3对成对电子,W核外有5个未成对电子.Y、Z分别形成氢化物Q和J,已知Q与J摩尔质量相等,Q的水溶液中加入少量WY2,立即产生大量气泡.E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:分析 X、Y、Z、R、W、E为前四周期元素且原子序数依次增大,X的单质与Y的单质在放电条件下反应产生大气污染物NO,则X是N、Y是O元素;R基态原子的M能层上有3对成对电子,M层电子排布式为3s23p5,则R是Cl元素;W核外有5个未成对电子,只能处于第四周期,外围电子排布为3d54s2,则W是Mn元素;Y、Z分别形成氢化物Q和J,Q与J摩尔质量相等,Q的水溶液中加入少量MnO2,立即产生大量气泡,则Q是H2O2、J是H2S,所以Z是S元素;E位于周期表的ds区,最外层只有一对成对电子,则E为Zn.
解答 解:X、Y、Z、R、W、E为前四周期元素且原子序数依次增大,X的单质与Y的单质在放电条件下反应产生大气污染物NO,则X是N、Y是O元素;R基态原子的M能层上有3对成对电子,M层电子排布式为3s23p5,则R是Cl元素;W核外有5个未成对电子,只能处于第四周期,外围电子排布为3d54s2,则W是Mn元素;Y、Z分别形成氢化物Q和J,Q与J摩尔质量相等,Q的水溶液中加入少量MnO2,立即产生大量气泡,则Q是H2O2、J是H2S,所以Z是S元素;E位于周期表的ds区,最外层只有一对成对电子,则E为Zn.
(1)X的氢化物是氨气、R的氢化物是HCl,二者相遇生成氯化铵,氯化铵中铵根离子和酸根离子之间存在离子键、N原子和H原子之间存在共价键;Mn元素在元素周期表中的位置为第四周期第ⅦB族,
故答案为:离子键、共价键;第四周期第ⅦB族;
(2)N、S元素形成的含氧酸有HNO2 HNO3、H2SO3、H2SO4,
NO2-中N原子价层电子对数是2+$\frac{5+1-2×2}{2}$3,含1对孤电子对,所以为V形结构,
NO3-中N原子价层电子对数是3+$\frac{5+1-2×3}{2}$=3,不含孤电子对,所以为平面三角形,
SO32-中N原子价层电子对数是3+$\frac{6+2-2×3}{2}$=4,含1对孤电子对,所以为三角锥形,
SO42-中N原子价层电子对数是4+$\frac{6+2-2×4}{2}$=4,不含孤电子对,所以为正四面体,
故答案为:HNO2 HNO3;H2SO3;
(3)氢气、S(s)、气态H2S的燃烧热分别为285.8 kJ/mol、296.8 kJ/mol、562.0 kJ/mol,则:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ/mol,
②S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol,
③H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(l)△H=-562.0 kJ/mol,
根据盖斯定律,③-①-②可得:H2S(g)═S(s)+H2(g),H2S分解时△H=285.8 kJ/mol+296.8 kJ/mol-562.0 kJ/mol=+20.6 kJ/mol,
所以其热化学方程式为H2S(g)═S(s)+H2(g)△H=+20.6 kJ/mol,
故答案为:H2S(g)═S(s)+H2(g)△H=+20.6 kJ/mol;
(4)在酸性溶液中,MnO4-能被H2O2还原为Mn2+,双氧水被氧化生成氧气,离子方程式为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,
故答案为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O;
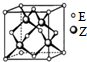
(5)Z与E能形成化合物A,晶胞中S原子数目为4,Zn原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Z的配位数为4,E的配位数为4,晶胞质量为4×$\frac{32+65}{{N}_{A}}$g,若晶胞边长为a,则晶体A的密度ρ=4×$\frac{32+65}{{N}_{A}}$÷a3=$\frac{4×97}{{a}^{3}×{N}_{A}}$,
故答案为:4;$\frac{4×97}{{a}^{3}×{N}_{A}}$.
点评 本题以元素推断为载体,考查结构性质位置关系、价层电子对互斥理论、热化学方程式书写、氧化还原反应、晶胞计算等,是对现实综合能力的考查,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO3→Na2SiO3 | |
| B. | Al→Al2O3→Al(OH)3→NaAlO2 | |
| C. | Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3 | |
| D. | S→SO3→H2SO4→SO2→Na2SO3→Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸浓度不变,使用量增大1倍 | B. | 盐酸浓度增加1倍,但用量减至1/2 | ||
| C. | 将碳酸钙固体改为碳酸钙粉末 | D. | 加热此反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com