
| ĪĀ¶Č/”ę | 400 | 500 | 800 |
| Ę½ŗā³£ŹżK | 9.94 | 9 | a |
| A | B | C | D | |
| c£ØCO2£© | 3 | 1 | 0.8 | 1 |
| c£ØH2£© | 2 | 1 | 0.8 | 1 |
| c£ØCO£© | 1 | 2 | 3 | 0.5 |
| c£ØH2O£© | 2 | 2 | 3 | 2 |
·ÖĪö £Ø1£©ÓɱķÖŠŹż¾ŻæÉÖŖÉżøßĪĀ¶ČĘ½ŗā³£Źż¼õŠ”£¬ĖµĆ÷Ę½ŗāÄęĻņŅĘ¶Æ£¬ŅŌ“ĖÅŠ¶Ļ·“Ó¦ČČ£»
£Ø2£©ŅĄ¾Ż»Æѧ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½¼ĘĖć·ÖĪö£»
£Ø3£©±£³ÖĪĀ¶Č²»±ä½ųŠŠ·“Ó¦£ŗCO£Øg£©+H2O £Øg£©?H2£Øg£©+CO2£Øg£©£¬4minŹ±·“Ó¦“ļµ½Ę½ŗā£¬²āµĆCOµÄ×Ŗ»ÆĀŹĪŖ60%£¬æÉÖŖĻūŗÄ1.2molCO£¬Éś³É1.2molCO2£¬ŅŌ“ĖæɼĘĖćCO2µÄĘ½¾ł·“Ó¦ĖŁĀŹ£¬¼ĘĖć³öĘ½ŗāŹ±ø÷ĪļÖŹµÄÅØ¶Č£¬æɼĘĖćĘ½ŗā³£Źż£»
øł¾Żø÷ĪļÖŹµÄÅØ¶Č¼ĘĖćÅضČĆŻÖ®»ż£¬ÓėĘ½ŗā³£ŹżĻą±Č½Ļ£¬æÉČ·¶ØŹĒ·ń“ļµ½Ę½ŗāדĢ¬£®
½ā“š ½ā£ŗ£Ø1£©ÓɱķæÉÖŖ£¬ĪĀ¶ČŌ½øߣ¬Ę½ŗā³£ŹżŌ½Š”£¬·“Ó¦½ųŠŠ³Ģ¶ČŌ½Š”£¬Ę½ŗāĻņÄę·“Ó¦ŅĘ¶Æ£¬ÉżøßĪĀ¶ČĘ½ŗāĻņĪüČČ·½ĻņŅĘ¶Æ£¬¹ŹÕż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬Äę·“Ó¦ĪŖĪüČČ·“Ó¦£¬¹Ź“š°øĪŖ£ŗĪüČČ£»
£Ø2£©·“Ó¦¢ŁC£Øs£©+CO2£Øg£©?2CO£Øg£©Ę½ŗā³£ŹżK=$\frac{{c}^{2}£ØCO£©}{c£ØC{O}_{2}£©}$£»
·“Ó¦¢ŚC£Øs£©+H2O£Øg£©?CO£Øg£©+H2£Øg£©Ę½ŗā³£ŹżK1=$\frac{c£Ø{H}_{2}£©•c£ØCO£©}{c£Ø{H}_{2}O£©}$£»
·“Ó¦¢ŪCO£Øg£©+H2O£Øg£©?H2£Øg£©+CO2£Øg£© Ę½ŗā³£ŹżK2=$\frac{c£Ø{H}_{2}£©•c£ØC{O}_{2}£©}{c£ØCO£©•c£Ø{H}_{2}O£©}$£»
ĖłŅŌ£ŗ$\frac{{K}_{1}}{{K}_{2}}$=$\frac{{c}^{2}£ØCO£©}{c£ØC{O}_{2}£©}$=K£¬
¹Ź“š°øĪŖ£ŗ$\frac{{K}_{1}}{{K}_{2}}$£»
£Ø3£©¢Ł±£³ÖĪĀ¶Č²»±ä½ųŠŠ·“Ó¦£ŗCO£Øg£©+H2O £Øg£©?H2£Øg£©+CO2£Øg£©£¬4minŹ±·“Ó¦“ļµ½Ę½ŗā£¬²āµĆCOµÄ×Ŗ»ÆĀŹĪŖ60%£¬æÉÖŖĻūŗÄ1.2molCO£¬Éś³É1.2molCO2£¬
v=$\frac{\frac{1.2mol}{2L}}{4min}$=0.15mol•L-1•min-1£¬
CO£Øg£©+H2O £Øg£©?H2£Øg£©+CO2£Øg£©
ĘšŹ¼£Ømol/L£© 1 1.5 0 0
×Ŗ»Æ£Ømol/L£©0.6 0.6 0.6 0.6
Ę½ŗā£Ømol/L£© 0.4 0.9 0.6 0.6
K=$\frac{0.6”Į0.6}{0.4”Į0.9}$=1£¬
¹Ź“š°øĪŖ£ŗ0.15£»1£»
¢ŚČē“ļµ½Ę½ŗā£¬ŌņĘ½ŗā³£ŹżK=1£¬
A.$\frac{c{£ØH}_{2}£©c{£ØCO}_{2}£©}{c£ØCO£©c{£ØH}_{2}O£©}$=$\frac{3”Į2}{1”Į2}$=3£¾1£¬Ć»ÓŠ“ļµ½Ę½ŗāדĢ¬£¬¹ŹA“ķĪó£»
B.$\frac{c{£ØH}_{2}£©c{£ØCO}_{2}£©}{c£ØCO£©c{£ØH}_{2}O£©}$=$\frac{1”Į1}{2”Į2}$=$\frac{1}{4}$Š”ÓŚ1£¬·“Ó¦ĻņÕż·“Ó¦½ųŠŠ£¬¹ŹB“ķĪó£»
C.$\frac{c{£ØH}_{2}£©c{£ØCO}_{2}£©}{c£ØCO£©c{£ØH}_{2}O£©}$=$\frac{0.8”Į0.8}{3”Į3}$£¼1£¬Ć»ÓŠ“ļµ½Ę½ŗāדĢ¬£¬¹ŹC“ķĪó£»
D.$\frac{c{£ØH}_{2}£©c{£ØCO}_{2}£©}{c£ØCO£©c{£ØH}_{2}O£©}$=$\frac{1”Į1}{0.5”Į2}$=1£¬“¦ÓŚĘ½ŗāדĢ¬£¬¹ŹDÕżČ·£®
¹Ź“š°øĪŖ£ŗD£®
µćĘĄ ±¾ĢāÖ÷ŅŖæ¼²éĘ½ŗā³£Źż¼°Ęä¼ĘĖć£¬ĪŖøßĘµæ¼µć£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦µÄ漲飬ÄŃ¶Č½Ļ“ó£¬×¢Ņā£Ø2£©Ę½ŗā³£ŹżŹéŠ“£¬£Ø3£©ÓŠ¹ŲĘ½ŗā³£ŹżµÄŌĖÓĆ£¬ĪŖŅדķµć£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| Ń¹Ēæ/MPa C% ĖŁ¶Č/”ę | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® |  | B£® |  | C£® |  | D£® |  |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | COµÄČ¼ÉÕČČĪŖ283kJ | |
| B£® | 25”ę”¢101 kPaŹ±£¬1 mol COŗĶ2 mol COµÄČ¼ÉÕČČĻąµČ | |
| C£® | 2Na2O2£Øs£©+2CO2£Øs£©ØT2Na2CO3£Øs£©+O2£Øg£©”÷H£¼-452 kJ/mol | |
| D£® | CO£Øg£©ÓėNa2O2£Øs£©·“Ó¦·Å³ö509 kJČČĮæŹ±£¬µē×Ó×ŖŅĘŹżĪŖ6.02”Į1023 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
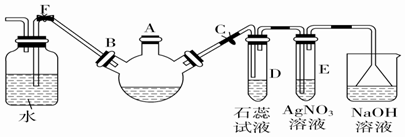
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2.0”Į10-7mol•L-1 | B£® | 0.1”Į10-7mol•L-1 | C£® | 5.0”Į10-6mol•L-1 | D£® | ĪŽ·ØČ·¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| I1 | I2 | I3 | I4 | ” |
| 496 | 4562 | 6912 | 9540 | ” |
 £¬ŗ¬ÓŠµÄ»Æѧ¼üĄąŠĶĄė×Ó¼üŗĶ¹²¼Ū¼ü£¬Z2Y2ĪŖĄė×Ó¾§Ģ壮
£¬ŗ¬ÓŠµÄ»Æѧ¼üĄąŠĶĄė×Ó¼üŗĶ¹²¼Ū¼ü£¬Z2Y2ĪŖĄė×Ó¾§Ģ壮²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ÓČėÉŁĮæCuSO4ČÜŅŗ | B£® | ¼ÓČėÉŁĮæK2SO4ČÜŅŗ | ||
| C£® | ¼ÓČėÉŁĮæµÄNa2CO3ČÜŅŗ | D£® | ½«Ļ”ĮņĖį»»ĪŖÅØĮņĖį |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com