
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=________。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是____________________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol·L-1 |
| B.若V1=V2,反应后溶液的pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
(10分)(1)1∶1
(2)①≥ ②> 根据电荷守恒,c(H+)+c(Na+)=c(OH-)+c(A-),由于c(OH-)>c(H+),故c(Na+)>c(A-) ③AD
解析试题分析::(1)H2SO4+2NaOH====Na2SO4+2H2O
(2×0.15×10-3V1—0.1×10-3V2)÷(10-3×(V1+V2))=10-1 mol·L-1
解得V1=V2∴V1∶V2=1∶1。
(2)①所得溶液中溶质仅有NaA,其若为强碱强酸盐,溶液pH=7;若为强碱弱酸盐,水解显碱性,溶液pH>7。
②由pH>7,可知c(OH-)>c(CH+),再由电荷守恒知c(Na+)+c(H+)=c(OH-)+c(A-),则c(Na+)>c(A-)。
③常温中性溶液中c(H+)=c(OH-)=1×10-7 mol·L-1,则c(H+)+c(OH-)=2×10-7 mol·L-1,A项说法正确。当HA为弱酸时,若V1=V2,反应后HA过量,所得溶液呈酸性,pH<7,B、C两项说法都不正确。HA可能是强酸,也可能是弱酸,c(HA)≥c(H+)="10-pH" mol·L-1=10-3 mol·L-1,而c(NaOH)=c(OH-)=10pH-14 mol·L-1=10-3 mol·L-1,若要混合液呈碱性,NaOH溶液必须过量,则V1一定小于V2,D项说法正确。
考点:酸碱中和
点评:此题考核了强弱酸与强弱碱间的反应对PH等的影响。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 10.0 | 20.0 | 30.0 |
| 生成气体的体积/mL(标准状况) | 89.6 | 179.2 | 224 |
| 16n(H2O2) |
| m(样品) |
查看答案和解析>>
科目:高中化学 来源: 题型:
请完成下列问题:
(1)已知M的相对分子质量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是_________。D是双原子分子,相对分子质量为30,则D的分子式为_________。
(2)油脂A经下列途径可得到M。
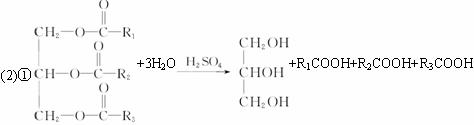
上框图中②的提示:
C2H5OH+HNO![]() C2H5ONO2+H2O
C2H5ONO2+H2O
硝酸乙酯
反应①的化学方程式是__________。
反应②的化学方程式是__________。
(3)C是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式_________。
(4)若将0.1 mol B与足量的金属钠反应,则需消耗__________g金属钠。
查看答案和解析>>
科目:高中化学 来源: 题型:
请完成下列问题:
(1)已知M的相对分子质量为227,由C、H、O、N 4种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是________。D是双原子分子,相对分子质量为30,则D的分子式为________。
(2)油脂A经下列途径可得到M。

图中②的提示:

反应①的化学方程式是______________________________________________________。
反应②的化学方程式是______________________________________________________。
(3)C是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式:______________________________________________。
(4)若将0.1 mol B与足量的金属钠反应,则需消耗________g金属钠。
查看答案和解析>>
科目:高中化学 来源:2010年福建省高三模拟考试(理综)化学部分 题型:实验题
(15分)
我国规定:室内甲醛含量不得超过0.0 8mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛(HCHO)的含量。
【查阅资料】KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛和草酸。
4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O
2MnO4―+5H2C2O4+6H+=2Mn2++10CO2 ↑+8H2O
【实验一】
按如图所示装置进行采样
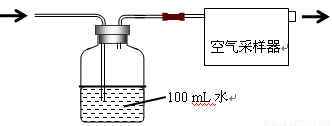
(1)由图可知甲醛的物理性质为
(2)空气中甲醛采样吸收装置中用到的玻璃仪器为:玻璃导管、
(3)为了使通过吸收装置的甲醛尽可能被吸收液吸收,可采取的措施是:(只写出一种即可) 。
设置空气采集器为恒定流量0.5 L/min,采集20min。
【实验二】
量取10.00 mL 的甲醛吸收液转移到锥形瓶中,量取12.00 mL 1.00×10-3 mol·L-1 KMnO4溶液于锥形瓶中,并滴入几滴稀H2SO4备用。
(4)用1.00×10-3 mol·L-1标准草酸溶液进行滴定,当
时,达到滴定终点。
(5)记录滴定所消耗的草酸溶液的体积。重复实验2次,消耗草酸溶液的体积分别为10.90 mL、10.02 mL、9.98 mL。计算该居室内空气中甲醛的浓度为 mg·m-3。
(6)若滴定过程中,发现滴定管下端开始有气泡,滴定后气泡消失,则测定结果将
(填“偏大”、“无影响”、“偏小”)
【实验三】
环境监测站工作人员采样后,将5.00 mL 的甲醛吸收液注入比色瓶中,再向比色瓶中注入显色试剂0.5 mL,盖紧瓶塞,摇匀,静置显色。当室内环境温度不同时,记录显色时间见下表。
|
环境温度/℃ |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
|
显色时间/min |
45 |
30 |
15 |
13 |
10 |
7 |
5 |
(7)由该表可以得出的结论是
(8)请用化学反应原理解释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com