
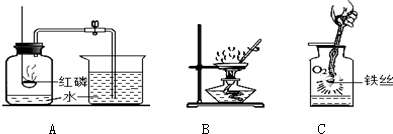
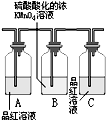
分析 (1)A中测得空气中氧气体积分数小于$\frac{1}{5}$,则氧气没有与红磷完全反应;
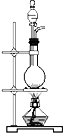
(2)B为蒸发操作,玻璃棒搅拌可防止局部温度过高;
(3)C中燃烧后生成四氧化三铁,温度较高,直接接触瓶底可使瓶底炸裂.
解答 解:(1)A中测得空气中氧气体积分数小于$\frac{1}{5}$,则氧气没有与红磷完全反应,则该实验中红磷的量不足,故答案为:红磷的量不足;
(2)B为蒸发操作,玻璃棒搅拌可防止局部温度过高,即搅拌的目的为使液体均匀受热,防止液体四处飞溅,故答案为:使液体均匀受热,防止液体四处飞溅;
(3)实验C中集气瓶内放少量水的目的是防止生成的熔化物溅落炸裂瓶底,故答案为:防止生成的熔化物溅落炸裂瓶底.
点评 本题考查实验装置及实验基本操作,为高频考点,把握反应原理、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶液 | 甲+乙 | 乙+丙 | 丙+丁 | 甲+丁 |
| 现象 | 无明显现象 | 白色沉淀 | 白色沉淀 | 无色气体 |
| A. | HCl、BaCl2、H2SO4、Na2CO3 | B. | H2SO4、HCl、BaCl2、Na2CO3 | ||
| C. | HCl、H2SO4、BaCl2、Na2CO3 | D. | H2SO4、Na2CO3、HCl、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:
断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:| 化学键 | H-H | Cl-Cl | O═O | C-Cl | C-H | O-H | H-Cl |
| E/kJ•mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.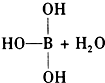 ?
?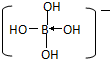 ++H+.
++H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
 |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com