
 ;
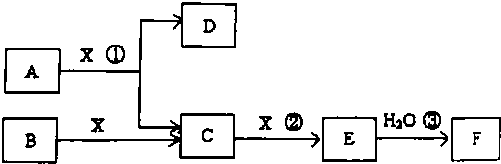
;分析 由短周期常见元素形成的纯净物A、B、C、D、E、F、X,D常温下为无色液体,应为H2O,B、X为单质,A、B含同一种元素,
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应,可知E为NO2,F为HNO3,A为NH3,X为O2,C为NO,B为N2,根据A的成键情况可判断A的分子构型,pH=a的氨水中加入pH=b的盐酸,a+b=14,说明氨水中c(OH-)与盐酸c(H+)相等,因一水合氨为弱电解质,若反应后溶液的pH<7,则盐酸体积较大,如二者体积相等,氨水过量,溶液呈碱性,盐酸过量,溶液呈酸性,据此比较离子浓度大小;
(2)若E为无色无味气体,F是二元弱酸,E为CO2,F为H2CO3,少量气体E通入氢氧化钡溶液中得不溶物H,则H为BaCO3,所以B为C,C为CO,X为O2,A为气态烃,KSP 只受温度的影响,温度比不变,则KSP 不变,由KSP 结合钡离子浓度可计算得碳酸根离子的浓度.
解答 解:由短周期常见元素形成的纯净物A、B、C、D、E、F、X,D常温下为无色液体,应为H2O,B、X为单质,A、B含同一种元素,
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应,可知E为NO2,F为HNO3,A为NH3,X为O2,C为NO,B为N2;
①A与X反应的化学方程式为4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O;
②A为NH3,氨分子中氮原子有一对孤电子对,含有三个N-H键,所以氨分子是三角锥形,
故答案为:三角锥形;
③反应③为NO2(g)+H2O(l)=2HNO3(aq)+NO(g),1mol气体NO2发生反应③放出46kJ热量,则3molNO2参加反应放出热量为138 kJ/,
所以热化学方程式为3 NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138 kJ/mol,
故答案为:3 NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138 kJ/mol;
④a+b=14,说明氨水中c(OH-)与盐酸c(H+)相等,因一水合氨为弱电解质,若反应后溶液的pH<7,则盐酸体积较大,如二者体积相等,氨水过量,溶液呈碱性,
盐酸过量,溶液呈酸性,离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(H+)>c(OH-)(盐酸过量较少) 或c(Cl-)>c(H+)>c(NH4+)>c(OH-)(盐酸过量较多)
故答案为:<;c(Cl-)>c(NH4+)>c(H+)>c(OH-) 或c(Cl-)>c(H+)>c(NH4+)>c(OH-);
(2)若E气体不是大气污染物,F是二元弱酸,E为CO2,F为H2CO3,B为C,C为CO,X为O2,A为气态烃,
①E为CO2,电子式为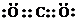 ,
,
故答案为: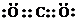 ;
;
②KSP 只受温度的影响,温度比不变,则KSP 不变,由KSP =c(Ba2+)×c(CO32-)=8.1×10-9可知,该沉淀放入0.1mol•L-1的BaCl2溶液中,c(Ba2+)=0.1mol•L-1,则c(CO32-)=8.1×10-8mol•L-1,
故答案为:不变; 8.1×10-8.
点评 本题考查无机推断,涉及知识点较多,能正确推断物质是解本题关键,难点是判断离子浓度大小顺序,根据溶液中的溶质来分析解答,难度较大.


科目:高中化学 来源: 题型:解答题
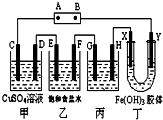 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属材料都是导体,非金属材料都是绝缘体 | |
| B. | 氢氧化铝可作胃酸的中和剂 | |
| C. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| D. | SO2溶于水能导电,SO2属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ba2+)=c(SO42-) | |
| B. | c(Ba2+)增大,c (SO42-) 减小 | |
| C. | c(Ba2+)≠c SO42-),c(Ba2+)•c(SO42-)=KSP(BaSO4) | |
| D. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)≠KSP(BaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

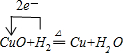
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
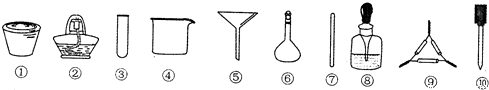
| A. | 将茶叶灼烧灰化,选用①、②和⑨ | |
| B. | 检验滤液中的Fe3+,选用③、⑧和⑩ | |
| C. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ | |
| D. | 过滤得到的滤液,选用④、⑤和⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中维生素C作还原剂 | |
| B. | 河虾与其它含维生素C较多蔬菜也不宜同食 | |
| C. | 河虾与西红柿同食发生了氧化还原反应 | |
| D. | 该反应中砷元素被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2++2OH-═Mg(OH)2↓ | B. | Mg(OH)2+2H+═2Mg2++2H2O | ||
| C. | Mg(OH)2═MgO+H2O | D. | MgCl2═Mg+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钡难溶于水,其水溶液导电能力极弱,所以硫酸钡不是电解质 | |
| B. | CO2溶于水得到的溶液能导电,所以CO2是电解质 | |
| C. | 酸、碱和盐类都属于电解质,其他物质都是非电解质 | |
| D. | 电解质与非电解质的本质区别是在水溶液或熔化状态下能否电离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com