
(1)请完成以上化学方程式,并回答实际生产中采用NaClO3来氧化Fe2+比较好的理由。
(2)配平下列离子方程式,并回答下列问题:
①□Fe(OH)3+□ClO-+□OH-====□![]() +□Cl-+□H2O
+□Cl-+□H2O
②已知有3.21 g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=_________,![]() 中铁的化合价为_____________。
中铁的化合价为_____________。
③根据①②推测,![]() 能与下列哪些物质反应_________(只填序号)。
能与下列哪些物质反应_________(只填序号)。
A.Cl2 B.SO2
C.H2S D.O2
解析:本题考查有关含有字母的离子型氧化还原反应方程式的配平,学会利用化合价升降配平法,灵活利用电荷守恒和质量守恒,正确标定元素的化合价是配平的基础,电子得失守恒的应用是解题的关键。
(1)依题意知,Fe2+以FeSO4形式存在,被氧化为Fe2(SO4)3;NaClO或NaClO3均被还原为NaCl,故两方程式均需H2SO4。
NaClO+2FeSO4+H2SO4====NaCl+Fe2(SO4)3+H2O
NaClO3+6FeSO4+3H2SO4====NaCl+3Fe2(SO4)3+3H2O
1 mol NaClO3可氧化6 mol FeSO4,而1 mol NaClO只能氧化2 mol FeSO4,故用NaClO3节省原料。
(2)①根据电子得失守恒、质量守恒配平方程式;②根据电子得失守恒,设![]() 中Fe的化合价为x,则(x-3)×
中Fe的化合价为x,则(x-3)×![]() ,可求得
,可求得![]() 中铁的化合价为+6价,则n=2;③高价铁具有强氧化性,Cl2和O2也具有强氧化性,故不能与
中铁的化合价为+6价,则n=2;③高价铁具有强氧化性,Cl2和O2也具有强氧化性,故不能与![]() 反应,所以选B和C。
反应,所以选B和C。
答案:(1)氧化相同物质的量的FeSO4所需NaClO3的物质的量比NaClO少,节省原料。
(2)①2Fe(OH)3+(5-n)ClO-+2nOH-====![]() +(5-n)Cl-+(n+3)H2O ②2 +6③BC
+(5-n)Cl-+(n+3)H2O ②2 +6③BC


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
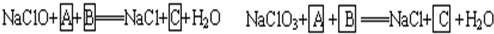
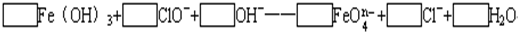
n- 4 |
n- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
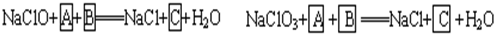
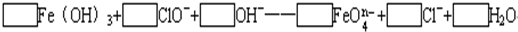
| n-4 |
| n-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
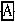 +
+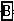 =NaCl+
=NaCl+ +H2O
+H2O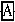 +
+ =NaCl+
=NaCl+ +H2O
+H2O Fe(OH)3+
Fe(OH)3+ ClO-+
ClO-+ OH-→
OH-→ Fe
Fe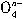 +
+ Cl- +
Cl- + H2O。
H2O。 中铁的化合价为_____________________。
中铁的化合价为_____________________。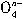 能与下列哪些物质反应(只填序号)______________。
能与下列哪些物质反应(只填序号)______________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com