
| A. | 煤的液化和气化都是化学变化 | |
| B. | 硝化反应和酯化反应都属于取代反应 | |
| C. | 石油的分馏和裂化都是化学反应 | |
| D. | 乙烯与溴和水的反应都属于加成反应 |
分析 A.产生了新物质的变化是化学变化;
B.有机化合物分子里的某些原子或原子团被其它原子或原子团所代替的反应是取代反应;
C.石油的分馏是利用石油中各种成分沸点不同将其分离的一种方法;裂化是将相对分子质量较大,沸点较高的烃断裂为相对分子质量较小、沸点较低的烃的过程;
D.有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应.
解答 解:A.煤的气化、液化都产生了新物质,都属于化学变化,故A正确;
B.硝化反应和酯化反应都是有机化合物分子里的某些原子或原子团被其它原子或原子团所代替的反应,都属于取代反应,故B正确;
C.石油的分馏属物理变化,因为石油的分馏是利用石油中各种成分沸点不同将其分离的一种方法,没有新物质生成,所以是物理变化,石油裂化是化学变化,故C错误;
D.乙烯使溴水褪色,是乙烯中的双键断裂,每个碳原子上结合1个溴原子生成1,2-二溴乙烯,乙烯和水加成生成乙醇,所以属于加成反应,故D正确.
故选C.
点评 本题主要考查了化学变化和常见有机反应类型的判断,题目难度不大,注意明确常见有机反应的类型及判断方法,明确含双键、苯环的物质能发生加成反应.


科目:高中化学 来源: 题型:选择题
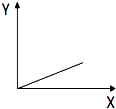
| A. | 一定状况下,气体摩尔体积(Y)与该气体的物质的量(X)的关系 | |
| B. | 将SO2通入NaOH溶液中至过量,生成Na2SO3的物质的量(Y)与消耗SO2的物质的量(X)的关系 | |
| C. | 向AlCl3溶液中滴加稀氨水至过量,生成Al(OH)3的物质的量(Y)与消耗NH3•H2O的物质的量(X)的关系 | |
| D. | H2SO4溶液的物质的量浓度(Y)与溶液体积(X)的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
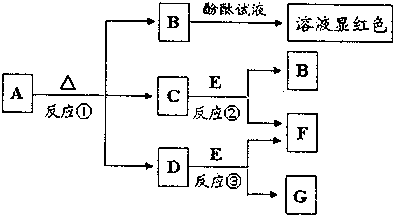
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 29.5g | B. | 44g | C. | 74.8g | D. | 88g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由三氯化铁到氢氧化铁胶体有发生化学变化发生 | |
| B. | 氢氧化铁胶体溶液的颗粒的直径在10-9~10-7m之间 | |
| C. | 可以用丁达尔效应实验有效鉴别氯化钠溶液和氢氧化铁溶液 | |
| D. | 三氯化铁可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2gO2和O3混合气体所含的氧原子总数为0.2NA | |
| B. | 一定条件下,2 mol SO2和1mol O2在密闭容器中充分反应后,容器内气体分子总数为2NA | |
| C. | 12g金刚石含4NA个C-C键 | |
| D. | 0.1 mol Na在空气中完全燃烧生成Na2O2,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
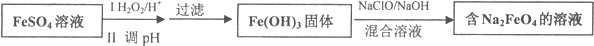
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com