
����Ŀ����ͼ��ʾ����ԲȦ�ཻ�IJ��ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1 mol��ˮ������Ϊ100 g������˵����ȷ����(����)

A. Na2O2������������Ŀ֮��Ϊ1��1
B. ��Ӧ�ٵ����ӷ���ʽΪNa��2H2O===Na����2OH����H2��
C. ���������۳�ַ�Ӧ��������Һ�����ʵ�������������>��>��
D. ��Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ0.1mol
���𰸡�D
��������A��������������������O22-����������������Ŀ֮��Ϊ1��2��A����B����Ӧ�ٵ����ӷ���ʽΪ��2Na��2H2O=2Na����2OH����H2����B����C���ơ������ơ��������ƺ�ˮ��Ӧ�ķ���ʽ�ֱ����£�
Na+H2O=NaOH+1/2H2������Һ���ӵ�����=m��Na��-m��H2��=2.3g-0.1g=2.2g��
Na2O+H2O=2NaOH����Һ���ӵ�����=m��Na2O��=0.1mol��62g/mol=6.2g��
Na2O2+H2O=2NaOH+1/2O2������Һ���ӵ�����=m��Na2O2��-m��O2��=6.2g��
������Һ���ӵ�������С˳��Ϊ���ƣ�������=�������ƣ�������ԭ���غ�֪��0.1mol���ơ������ơ�������������ˮ�����������Ƶ����ʵ����ֱ�Ϊ��0.1mol��0.2mol��0.2mol��ͨ�����Ϸ�����֪��0.1mol���ơ������ơ��������Ʒֱ�����ˮ������Һ�����������ֱ�Ϊ��4g/102.2g��8g/106.2g��8g/106.2g�����Ԣ١��ڡ��۳�ַ�Ӧ��������Һ�����������Ӵ�С���٣���=����C������D����Ӧ����ʽΪ��
2Na2O2+2H2O=4NaOH+O2��
2mol 1mol
0.1mol 0.05mol
1mol�������Ʋ��뷴Ӧת��1mol���ӣ����Է�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ0.1mol��D��ȷ����ѡD��


 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaOH��MgCl2��AlCl3���ֹ�����ɵĻ������������ˮ�к���1.16g��ɫ����,�����õ�����Һ����μ���1mol��L-1HCl��Һ,����HCl��Һ�����V�����ɳ���������m�Ĺ�ϵ��ͼ��ʾ���Իش�

��1��A�������Ļ�ѧʽΪ_____________��A����Һ�е�������___________________��B�������Ļ�ѧʽΪ____________________��
��2��ԭ�������MgCl2�����ʵ���Ϊ________________,AlCl3�����ʵ���Ϊ__________,NaOH�����ʵ���Ϊ________________��
��3��HCl��Һ��Q��ļ�������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��л����˵����ȷ����
A. �����л��������ϩ������ϩ�����������������ԭ�Ӿ���ͬһƽ����
B. �л���![]() �ķ���ʽ��C10H18O
�ķ���ʽ��C10H18O
C. ��ͬ�������������顢�����顢������ķе���������
D. ��1-�����ˮ����1-�������ɱ�ϩ��ˮ��Ӧ�Ʊ���������ͬһ��Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���������ԭ�Ӷ����������Ϊ8���ӽṹ����
A��CCl4 B��H2O C��BF3 D��PCl5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ������ܴﵽʵ��Ŀ�ĵ��ǣ� ��
ʵ��Ŀ�� | ʵ����� | |
A | �Ƚ�ˮ���Ҵ�����Ļ����� | �ֱ�������Ͷ�뵽ʢ��ˮ���Ҵ����ձ��� |
B | ����ϡ���� | �Ƚ�Ũ��������ձ��У���������ˮ |
C | ��ȥCu���л��е�CuO | ����ϡ������Һ�����ˡ�ϴ�ӡ����� |
D | ֤��SO2����Ư���� | ��SO2ͨ����ɫʯ����Һ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҹ��½�������ִ�����12�ڶֵĴ������ʯ�͵ķ��������û�е���
A. ���� B. �ƾ� C. ú�� D. ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2X(g)+Y(g)![]() 2Z(g)��ij�о�С�齫4 mol X��2 mol Y����һ�ݻ�������ܱ������У��ⶨ��ͬʱ�����X��ת���ʣ��õ����±����ݣ�
2Z(g)��ij�о�С�齫4 mol X��2 mol Y����һ�ݻ�������ܱ������У��ⶨ��ͬʱ�����X��ת���ʣ��õ����±����ݣ�
t��min�� | 2 | 4.5 | 5 | 6 |
Xת���� | 30�� | 40�� | 70�� | 70�� |
����������Ϣ�����������ж�����ȷ���ǣ� ��
A. ���ŷ�Ӧ�Ľ��У����������ܶȲ�������
B. ��Ӧ��5.5 minʱ��v��(X)=v��(Z)
C. 6 minʱ��������ʣ��1.4 mol Y
D. Y��ת����С��70��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��̬��A�ڱ�״���µ��ܶ�Ϊ1.25g/L�������������������һ�����ҵ�ʯ�ͻ�����չˮƽ��B��D���������г������л��D�ܸ�̼�����Ʒ�Ӧ��F����ζ������֮���ת����ϵ����ͼ��ʾ��

��1��A�Ľṹ��ʽΪ_____��B�й����ŵĵ���ʽΪ____��D�й����ŵ�����Ϊ_________��
��2����Ӧ�ٵķ�Ӧ������________����Ӧ�۵Ļ�ѧ����ʽΪ��_______________��
��3����Ӧ����Cu�������������½��У���ʵ��IJ����ǽ�������ͭ˿���ھƾ����ϼ��ȣ�
��ͭ˿��Ϊ��ɫʱ��Ѹ�ٽ�����뵽װ��B���Թ��У���ͼ��ʾ�����ظ�����2-3�Σ��۲쵽��������__________________________________________���÷�Ӧ�Ļ�ѧ����ʽΪ_____________��

��4��D��̼��������Һ��Ӧ�����ӷ���ʽΪ______________________________��
��5��B��D��Ũ�����������ʵ�ַ�Ӧ�ܣ�ʵ��װ������ͼ��ʾ��
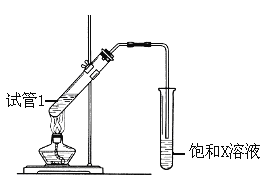
ͼ��X�Ļ�ѧʽΪ_________��Ũ�����������__________��
�÷�Ӧ�Ļ�ѧ����ʽΪ_____________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com