
| A. | 分别蘸有浓氨水和浓盐酸的两根玻璃棒靠近时有白烟生成 | |
| B. | 氨气极易溶解于水,因此可用来做喷泉实验 | |
| C. | 氯化铵受热分解有氨气生成,因此实验室可以用加热氯化铵的方法制备氨气 | |
| D. | 氨具有还原性,可以被氧化成NO |
分析 A.浓氨水易挥发出氨气分子,浓盐酸易挥发出氯化氢分子,氨气和氯化氢相遇反应生成固体氯化铵;
B.依据喷泉实验的原理分析,需要气体易溶于水,减小容器中的压强形成喷泉;
C.氯化铵受热分解成氨气和氯化氢,但氨气和氯化氢一冷却马上又可以化合成氯化铵,这个方案很难制氨气;
D.依据氨气中氮元素化合价判断氨气的性质,氮元素化合价为最低价-3价.
解答 解:A.浓氨水易挥发出氨气分子,浓盐酸易挥发出氯化氢分子,分别蘸有浓氨水和浓盐酸的两根玻璃棒靠近时有白烟生成,NH3+HCl=NH4Cl,故A正确;
B.易溶于水,减小容器中的压强形成喷泉,氨易溶解于水,因此可用来做喷泉实验,故B正确;
C.加热氯化铵生成氨气和氯化氢,氨气和氯化氢遇冷又生成氯化铵,很难制取氨气,故C错误;
D.氨气中氮元素处于最低价-3价,化合价能够升高为一氧化氮中的+2价,所以氨气能够被氧化生成一氧化氮,故D正确;
故选C.
点评 本题考查了氨气性质的分析判断,掌握氨气性质是解题关键,注意氨气的稳定性决定因素,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①③② | B. | ①②③ | C. | ②③① | D. | ②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
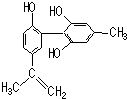 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入KMnO4(H+)溶液,观察紫色褪去,说明结构中有一定存在不饱和碳碳双键 | |
| C. | 1 mol该物质分别与浓溴水、H2反应时最多消耗Br2和H2分别为4mol、7 mol | |
| D. | 该分子中的所有原子有可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于元素周期表和元素周期律的发现有突出贡献的科学家是阿伏加德罗 | |
| B. | 因为氯元素非金属性比硫元素强,所以次氯酸的酸性比硫酸强 | |
| C. | 每一周期都是从金属元素开始,非金属元素结束 | |
| D. | 现常见的元素周期表有七个横行,即七个周期,有18个纵行,分为16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硬度比生铁低 | B. | 在潮湿空气中放置不易生锈 | ||
| C. | 可溶在稀H2S04中 | D. | 熔点比生铁低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com