
 ����������SeO2����һ�����������䱻��ԭ��ĵ��������ܳ�Ϊ������Ⱦ�ͨ����ŨHNO3��H2SO4��Ӧ����SeO2�Ի���Se�����������գ�
����������SeO2����һ�����������䱻��ԭ��ĵ��������ܳ�Ϊ������Ⱦ�ͨ����ŨHNO3��H2SO4��Ӧ����SeO2�Ի���Se�����������գ����� ��1������������Ϣ��֪Se��ŨHNO3��Ӧ��Se������Ϊ+4�۵�H2SeO3��HNO3��ԭΪNO��NO2�����õ����غ��������������NO��NO2�����ʵ���֮��Ϊ1��1����������ϵ����Ϊ1��1���ɵ÷���ʽ��������ֻ�ԭ���������
��2�����ݷ�Ӧ�ķ���ʽ��֪��SeO2��2I2��4Na2S2O3������n=cV�������ĵ�n��Na2S2O3�������ݹ�ϵʽ������Ʒ��n��SeO2�����ٸ���m=nM����SeO2������������������Ʒ��SeO2������������
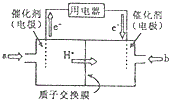
��3���ٸ���ͼ֪������Ĥ�����ӽ���Ĥ����������Һ�����ԣ������������ƶ�����֪��ͨ��a�ĵ缫Ϊ������ͨ��b�ĵ缫Ϊ�����������ϼ״�ʧȥ���ӷ���������Ӧ��
�ڸ��ݵ��صĹ���ԭ���͵缫����ʽ�����㣮
��� �⣺��1������������Ϣ��֪Se��ŨHNO3��Ӧ��Se������Ϊ+4�۵�H2SeO3��HNO3��ԭΪNO��NO2������NO��NO2�����ʵ���֮��Ϊ1��1����������ϵ����Ϊ1��1�������ϵ��Ϊ1�����ݵ���ת���غ��֪��Se��ϵ��Ϊ$\frac{1��3+1��1}{4}$=1���ʷ�Ӧ����ʽΪSe+2HNO3��Ũ��=H2SeO3+NO��+NO2�����粻�Ը÷�Ӧ��ԭ����ı��������ƣ��÷�Ӧ���ܳ��ֶ�����ƽϵ��������÷�Ӧ�����ֻ�ԭ������ߵı����ͻ�ԭ�������������Է����ı䣻
�ʴ�Ϊ��Se+2HNO3��Ũ��=H2SeO3+NO��+NO2�������ܣ��÷�Ӧ�����ֻ�ԭ������ߵı����ͻ�ԭ�������������Է����ı䣻
��2�����ݷ�Ӧ�ķ���ʽ��֪SeO2��2I2��4Na2S2O3�����ĵ�n��Na2S2O3��=0.2000 mol/L��0.025L=0.005mol�����ݹ�ϵʽ������Ʒ��n��SeO2��=0.005mol��$\frac{1}{4}$=0.00125mol����SeO2������Ϊ0.00125mol��111g/mol=0.13875g��������Ʒ��SeO2����������Ϊ$\frac{0.13875g}{0.1600g}$��100%=86.6%���ʴ�Ϊ��86.6%��
��3���ٸ���ͼ֪������Ĥ�����ӽ���Ĥ����������Һ�����ԣ������������ƶ�����֪��ͨ��a�ĵ缫Ϊ������ͨ��b�ĵ缫Ϊ�����������ϼ״�ʧȥ���ӷ���������Ӧ��������ӦʽΪ CH3OH-6e-+H2O=CO2+6H+�������������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪO2+4e-+4H+=2H2O��
�ʴ�Ϊ������CH3OH-6e-+H2O=CO2+6H+��
���ô˵���Զ��Ե缫��ⱥ��ʳ��ˮ�ĵ缫��ӦΪ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$H2��+Cl2��+2OH-�����������ռ�����״���µ�����1.12L��0.05mol��ʱ���������������Ƶ����ʵ�����0.05mol������COH-=$\frac{0.05mol}{0.5L}$=0.1mol/L������PH=13���ʴ�Ϊ��13��
���� ���⿼��������ԭ��Ӧ�������Լ��绯ѧ��֪ʶ�ȣ�Ϊ��Ƶ���㣬�����غ㷨Ϊ���Ĺؼ�������������ԭ��Ӧ��ƽ������Ŀ��飬ע�����ջ���֪ʶ�����գ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������һ����Ȼ�������彡��Ӱ�첻�� | |
| B�� | PM2.5��ָ������ֱ��С�ڻ����2.5��m�Ŀ����� | |
| C�� | ������SO2���������ӻᵼ������ЧӦ�Ӿ� | |
| D�� | ������pHС��7����ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���н�����һ����Ӧ | |
| B�� | Fe3+�ܴ�H2O2�ķֽ� | |
| C�� | ��Ӧ��������ҺpH���ϼ�С | |
| D�� | FeSO4������ʵ�����H2O2ǡ�÷�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
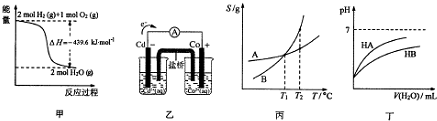
| A�� | �ɼ���֪������ȼ����Ϊ219.8kJ•mol-1 | |
| B�� | ������֪���ӷ�ӦCo2+��ap��+Cd��s���TCo��s��+Cd2+��ap�����Է��� | |
| C�� | �ɱ���֪����A��B������Һ�ֱ���T1������T2��ʱ�����ʵ�����������B��A | |
| D�� | �ɶ���֪��ͬ�¶ȡ�ͬŨ��NaA��Һ��NaB��Һ��ȣ���pH��NaA��NaB |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ��ʵ | ��ѧ����ʽ |
| A | �����£�������������ʢ��Ũ���� | A l+3HNO3��Ũ��=Al��OH��3+3NO2�� |
| B | ������ʯ������ҵ���������� | 2CaO+2SO2+O2=2CaSO4 |
| C | ���MgCl2��Һұ��Mg | MgCl2$\frac{\underline{\;���\;}}{\;}$Mg+Cl2�� |
| D | ��°��ñ���ʳ��ˮ����ˮ��CO2�Ʊ����� | 2NaCl+2NH3+CO2+H2O=2NH4Cl+NaCO3 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1L 1 mol•L-1�����к���nA��HCl���� | |
| B�� | 32g O2��O3�Ļ���ﺬ��2nA����ԭ�� | |
| C�� | 1L 1 mol•L-1CuCl2��Һ�к���nA��Cu2+ | |
| D�� | 1mol Na������Cl2��Ӧ��ת��2nA������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 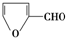 | B�� |  | C�� | ��CH3��3CCHO | D�� | CH3CHO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
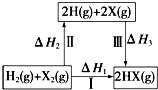
| A�� | 2H��g��+2X��g���T2HX��g����H3��0 | |
| B�� | ����HX�ķ�Ӧ����;���أ����ԡ�H1=��H2+��H3 | |
| C�� | F��Cl��Br�ķǽ��������μ���������;�������յ������������� | |
| D�� | F2��Cl2�ֱ�����ӦI��ͬһ�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2����K1��K2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com