
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 5种 |
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:解答题
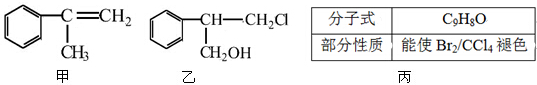
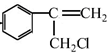 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙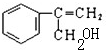 +HCl$\stackrel{一定条件}{→}$
+HCl$\stackrel{一定条件}{→}$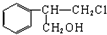 (不需要注明反应条件)
(不需要注明反应条件)
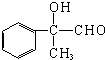 ;丙的结构简式为
;丙的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 甲烷在空气中燃烧 | D. | 加热条件下H2与CuO反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | |
| W |
 (1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为
(1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为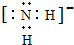 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制催化剂的材料 | B. | 半导体材料 | ||
| C. | 制农药的材料 | D. | 耐高温、耐腐蚀的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能自发进行的氧化还原反应,也可以通过电解来实现 | |
| B. | 电解质溶液导电是化学变化,金属导电是物理变化 | |
| C. | 电解池和原电池中均发生氧化还原反应 | |
| D. | 电解、电离、原电池均需要通电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 氮的固定只有在高温、高压、催化剂的条件下才能实现 | |
| C. | 服用铬含量超标的药用胶囊会对人体健康不会造成危害 | |
| D. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
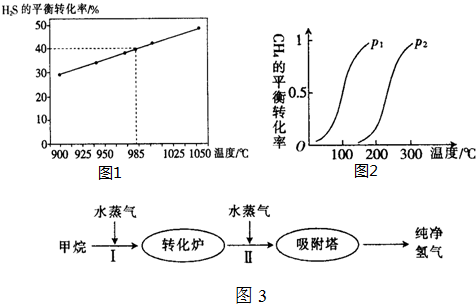
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com