
【题目】把下列物质分别加入盛水的锥形瓶,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如如图所示变化( )

① NH4NO3晶体 ② 浓H2SO4 ③ NaOH粉末
④ NaCl晶体 ⑤ Na2O2固体 ⑥ 生石灰
A. ①②④⑤ B. ①②③
C. ③④⑤ D. ②③⑤⑥
【答案】D
【解析】
U形管中的液面左低右高,出现这种现象的实质是锥形瓶内的气压高于大气压,锥形瓶内气压增大的原因,可能是化学反应生成了气体,也可能是物质溶解或化学反应放出热量,还可能是既生成气体又放出热量。据此分析可得结论。
①硝酸铵晶体溶于水吸收热量,锥形瓶内的气体压强减小,不符合题意;② 浓H2SO4溶于水放热,锥形瓶内的气体压强增大,符合题意;③NaOH粉末溶于水放热,锥形瓶内的气体压强增大,符合题意;④ NaCl晶体溶于水无明显热效应,锥形瓶中压强无明显变化,不符合题意;⑤Na2O2与H2O反应2Na2O2+2H2O═4NaOH+O2↑,生成O2并放出热量,锥形瓶内的气体压强增大,符合题意;⑥生石灰与H2O反应CaO+H2O=Ca(OH)2,放出热量,锥形瓶内的气体压强增大,符合题意;综上所述,②③⑤⑥符合题意,故答案选D。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】500 多年前,一艘载着天然苏打晶体(Na2CO3·10H2O)的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭。之后他们惊奇地发现,在苏打与沙粒接触的地方出现了许多晶莹发亮的珠子。回答下列问题:
(1)沙滩上沙粒的主要成分为_______(填化学式)。
(2)上述晶莹发亮的珠子可能是______(填字母)。
A. 水晶颗粒 B.无水碳酸钠 C.晶体硅 D.玻璃珠
(3)生成该珠子时发生反应的化学方程式为_____________。
(4)氢氟酸常用作玻璃的蚀刻剂,原因是______________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)北京市场销售的某种食用精制盐包装袋上有如下说明:

Ⅰ.碘酸钾与碘化钾在稀硫酸酸化条件下发生如下反应:KIO3+5KI+ 5H2SO4=3K2SO4+ 3I2+3H2O
甲乙两位同学分别用不同的方法配制所需的100mL 3.6molL﹣1的稀硫酸。
(1)若采用18molL﹣1的浓硫酸配制溶液,需要用量筒量取浓硫酸的体积为_______mL;
(2)甲学生:量取浓硫酸,在烧杯中稀释,冷却至室温后转移到100mL容量瓶中,洗涤,然后定容,塞好瓶塞,反复上下颠倒摇匀。配制过程中多次用到玻璃棒,其主要作用是______________________。
(3)若实验中进行下列操作使硫酸溶液的物质的量浓度偏高的是_____________。
①定容时观察液面俯视②未经冷却趁热将溶液注入容量瓶中
③摇匀后发现液面低于刻度线再加水④容量瓶中原有少量蒸馏水
(4)乙学生:用100mL量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加水至100mL刻度线,搅拌均匀,你认为此法是否正确?若不正确,指出其中错误之处__________________。
Ⅱ.已知上述反应生成的I2可发生如下反应:I2+2S2O32—=2I-+S4O62—。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取w g食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为1.0×10-3mol/L 的Na2S2O3溶液20.0 mL,恰好反应完全。
(1)b中反应所产生的I2的物质的量是________ mol。
(2)根据以上实验和包装袋说明,所测精制盐的碘含量是_______________ mg/kg。(以含w的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,能大量共存的是离子组是 ( )
A.Mg2+、Fe2+、NO3-、SCN-B.Al3+、Fe2+、Cl-、SO42-
C.K+、Na+、Cl-、HCO3-D.Na+、Ba2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有下列8种有机物按要求作答:
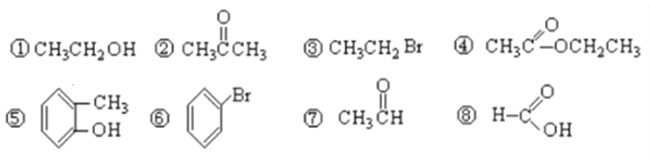
(1)按官能团分类,其中属于羧酸的有___________(填序号),属于醇的有_________(填序号);
(2)④中所含官能团的名称_______________,⑦中所含官能团结构简式_____________;
II.下列各组中的两种有机物,可能是:A.同一物质 B.同系物 C.同分异构体,请判断它们之间的关系(用字母完成填空):
(3)2-甲基丁烷和丁烷_______________;
(4)正戊烷和新戊烷_________________;
(5)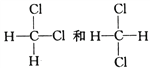 ______________。
______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为原子序数依次增大的5种短周期元素。A是最轻的金属,B的最低负化合价的绝对值比最高正化合价少2,C的简单阴离子C2-与氖原子有相同的电子层结构,D与A同主族,E的M层电子数比L层少2个。
(1)写出元素符号:A______、C______,E在元素周期表中的位置是________________;
(2)C、D、E原子半径由大到小:______(写元素符号,后同),C、D、E简单离子的半径由大到小_____;
(3)A常用作电池的电极材料,含A的电池通常采用非水电解质或固体电解质,原因是______(用化学方程式解释);
(4)B与氢元素可以形成10电子微粒X和18电子微粒Y,Y是一种良好的火箭燃料。X中含有的共价键类型是_______,Y的电子式为_________;
(5)C的两种单质在常温下都是气体,它们互为____________。比较C的氢化物和E的氢化物沸点:C___E(填“>”“<”或“=”),原因是____________
(6)用电子式表示D与E的二元化合物的形成过程:________________,碳原子与E能形成AB2型化合物,请写出该物质的电子式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅有多种方法,其中的一种工艺流程如下:

已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2![]() CO2↑+Si
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A与NaOH的醇溶液混合加热得产物C和溶液D。C与乙烯混合在催化剂作用下可反应生成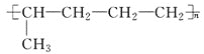 的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
A. 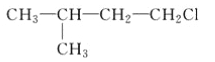 B.
B. 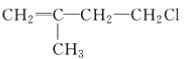 C. CH3CH2CH2ClD.
C. CH3CH2CH2ClD. 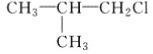
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或试剂的选择不合理的是 ( )
A. 铁丝能代替铂丝来做焰色反应实验B. 容量瓶用蒸馏水洗涤后须烘干才能使用
C. 用分液漏斗分离水和CCl4混合物D. 用品红溶液鉴别SO2和CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com