
氯及其化合物是中学化学中的重要研究对象之一。
(1)在实验室中常用二氧化锰和浓盐酸制取氯气,写出有关反应的离子方程式______________________;
(2)实验室也可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若用该反应制取标准状况下1.344 L氯气,反应过程中转移电子的物质的量为_________;
(3)某同学用排空气法收集一瓶氯气并进行氯气与铁反应的实验:取一根细铁丝,用砂纸将铁丝擦至光亮,用坩埚钳夹住,在酒精灯上烧至红热,铁丝保持红热,然后立即伸入充满氯气的集气瓶中,观察到的现象是______________________。向反应后的集气瓶中加入适量的蒸馏水,振荡,然后向所得溶液中滴加亚硫酸钠溶液,再滴加氯化钡溶液发现溶液变浑浊。写出上述反应的离子方程式:___________________ 、_____________________。
(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(2)0.1 mol
Mn2++Cl2↑+2H2O(2)0.1 mol
(3)产生红棕色的烟;2Fe3++SO32-+H2O=2Fe2++SO42-+2H+; SO42-+Ba2+=BaSO4↓
解析试题分析:(1)实验室中常用二氧化锰和浓盐酸在加热条件下制取氯气,生成二氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)实验室利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,根据价态归中规律知,KClO3中氯元素化合价由+5价变为0价,HCl中氯元素化合价由-1价变为0价,生成3mol Cl2转移5mol电子,标准状况下1.344 L氯气的物质的量为0.06mol,反应过程中转移电子的物质的量为0.1 mol;
(3)铁丝在氯气中燃烧发生反应3Cl2 +2Fe 2FeCl3,FeCl3固体为棕色,现象为产生红棕色的烟;氯化铁溶液与亚硫酸钠溶液反应,Fe3+被还原为Fe2+,SO32-转化为SO42-,离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+; SO42-+Ba2+=BaSO4↓。
2FeCl3,FeCl3固体为棕色,现象为产生红棕色的烟;氯化铁溶液与亚硫酸钠溶液反应,Fe3+被还原为Fe2+,SO32-转化为SO42-,离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+; SO42-+Ba2+=BaSO4↓。
考点:考查氯气的实验室制备和性质、氧化还原反应及离子方程式书写。


科目:高中化学 来源: 题型:填空题
某同学利用如图装置制NO并进行相关实验探究。
(1)写出制备NO的反应方程式
(2)收集的气体与空气混合后变红色,这说明NO具有_____性。
(3)制备NO的步骤如下:
1按图所示连接好装置;
2取下注射器,通过U型长管加入稀硝酸至接近U型短管的铜丝
3在针头上安装好注射器,抽出U型短管中的所有空气;然后拔出注射器,并排尽注射器中的空气。
4待硝酸与铜丝分离后,用已排除空气的注射器抽出生成NO,将注射器针头插入橡皮塞中以封口。
在上述操作中遗漏的一个步骤是 ,在步骤3中可以观察到的现象为 。
(4)在铜丝上绑上石墨的作用是 。
(5)若将稀硝酸换成浓硝酸,则可制取NO2气体。请你用注射器收集NO2气体并完成“外界因素对化学平衡移动影响”实验探究,相关内容填在下面表格。(只完成一个影响因素的探究,其他实验用品自选)已知
2NO2(g)  N2O4(g) △H <0;N2O4为无色气体。
N2O4(g) △H <0;N2O4为无色气体。
| 实验步骤 | 实验现象 | 实验结论 |
| ①分别用两支注射器收集NO2,并将注射器针头插入橡皮塞中以封口。 ②_____________________ _______________________ ________________________ _______________________ ________________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A、B、C所示。
(1)在相同条件下,三种气体在水中溶解度最大的是________(写化学式)写出A烧杯中发生反应的化学方程式:____ 。如果在三只烧杯中分别滴几滴紫色石蕊试液,可观察到的现象是_____________________ 。
实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图D、E、F所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
(2)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:
_______________________________________________。
②假设该实验条件下,气体摩尔体积为a L·mol-1。则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________________。
(3) 写出实验F通入氧气后,发生反应的化学方程式:____________________________。
(4)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,可能观察到的现象为________,用有关的离子方程式解释原因:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心e处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体上滴加一滴浓盐酸,再立即将表面皿盖好。(已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O)
(1)e处反应的离子方程式为_____________________,该反应中发生反应的氧化剂和还原剂的物质的量之比为 。
(2)b处的实验现象为________________,d处的实验现象为___________________。
(3)c处反应的化学方程式为_______________________ ______,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱? (填“能”或“不能”),若能,其氧化性由强到弱的顺序是 。(若不能,此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx,反应原理为:
 。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
①装置A中发生反应的化学方程式为 。
②装置D中碱石灰的作用是 。
(2)工业上也常用Na2CO3溶液吸收法处理NOx。已知:NO不能与Na2CO3溶液反应,
NO+ NO2+Na2CO3=2NaNO2+ CO2;2NO2+Na2CO3= NaNO2+ NaNO3+CO2.
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是 (填字母)。
A.1.3 B.1.6 C.1.8
②将1 mol NOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO—3、NO—2两种离子的物质的量随x变化关系如图所示:
图中线段a表示 离子随x值变化的关系;若用溶质质量分数为21.2%的Na2CO3溶液吸收,则需要Na2CO3溶液至少 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaC1O2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖,油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaC1O2的溶解度随温度升高而增大,适当条件下可结晶析出NaC1O2·3H2O.
②纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
I.请根据上述流程回答下列问题
(1)发生器中鼓入空气的作用可能是
(2)吸收塔内的反应的化学方程式为 .吸收塔的温度不能超过20℃,其目的是 .
(3)在碱性溶液中NaC1O2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 .
(4)从滤液中得到NaC1O2·3H2O粗晶体的实验操作依次是 .
II.上述流程中的原料NaC1O3可由氯气通入热的烧碱溶液后重结晶就得到比较纯净的产品,所以通常工厂联合氯碱车间制备.
(1)氯碱工业中的原料为 ,原料需要净化的原因是 ,阳极产品为
(2)工业生产NaC1O3的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
⑴一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________(填字母)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系中SO3的体积分数保持不变 d.每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
⑶右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。
⑷工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO2+CO2
2NO2+Na2CO3=NaNO2+NaNO3+CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为
____________。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下: 
(1)焦炭在过程Ⅰ中作______剂。
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是 。
(3)整个制备过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是 。
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中。冷却的作用是 。
(4)Zn还原SiCl4的反应如下:
反应1: 400℃~756℃ ,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(l) ΔH1 <0
Si(s) + 2ZnCl2(l) ΔH1 <0
反应2: 756℃~907℃ ,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(g) ΔH2 <0
Si(s) + 2ZnCl2(g) ΔH2 <0
反应3: 907℃~1410℃,SiCl4(g) + 2Zn(g)  Si(s) + 2ZnCl2(g) ΔH3 <0
Si(s) + 2ZnCl2(g) ΔH3 <0
① 对于上述三个反应,下列说法合理的是_____。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率 d.Na、Mg可以代替Zn还原SiCl4
② 实际制备过程选择“反应3”,选择的理由是 。
③ 已知Zn(l)=Zn(g) ΔH =" +116" KJ/mol 。若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出_____kJ的热量。
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化为H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
碳及其化合物有广泛的用途。
(1)在电化学中,常用碳作电极:
①在酸性锌锰干电池中,碳棒作 极。
②若用碳棒和铁棒做电极电解饱和食盐水生产烧碱时,碳棒作 极,反应的离子方程式 。
(2)将水蒸气通过红热的碳可产生水煤气:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。
CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。
| A.升高温度 | B.增加碳的用量 |
| C.加入催化剂 | D.用CO吸收剂除去CO |
 CO2(g)+H2(g)得到如下数据:
CO2(g)+H2(g)得到如下数据:| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
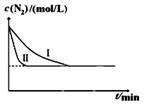
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com